Сравнительная геномная гибридизация, CGH array
Библиотека: статьи, полезная информация. Стихи, видео и фильмы про ЭКО.Метод сравнительной геномной гибридизации на микрочипах (aCGH) позволяет одновременно оценить все 24 хромосомы. Данный метод обладает высокой чувствительностью и точностью и позволяет проводить анализ по единственной клетке. Валидация метода aCGH, по данным литературы, показала его высокую эффективность: только для 2,9% эмбрионов результат анализа не был получен, а уровень ошибки составил 1,9%.
МАТЕРИАЛ И МЕТОДЫ:
Методом аCGH проведена диагностика на 70 бластоцистах у 11 пациенток. Возраст пациенток составил от 25 до 43 лет. Эмбрионы культивировали до 5-го дня, согласно стандартным протоколам лаборатории ЭКО, в индивидуальных каплях на средах фирмы «Origio» в условиях пониженного содержания кислорода (5% О2, 6% СО2). На 4-й день развития всем эмбрионам был выполнен вспомогательный хэтчинг с использованием лазера (Saturn, RI). В случае проведения диагностики на ранее замороженных бластоцистах эмбрионы размораживали накануне, проводили вспомогательный хэтчинг, а биопсию выполняли на следующий день, после чего повторно замораживали. На 5-й день развития на эмбрионах хорошего качества была проведена биопсия клеток трофэктодермы с использованием лазера. Эмбрионы, не достигшие соответствующей стадии развития,
культивировали до 6-го дня для последующей биопсии в случаях, если она становилась возможна. Сразу после проведения биопсии все бластоцисты были заморожены методом витрификации. Дальнейшие преамплификация, амплификация, гибридизация проб и анализ результатов проводились согласно стандартному протоколу (24Sure, BlueGnome).
РЕЗУЛЬТАТЫ:
Результат получен для 64 бластоцист (табл. 2).
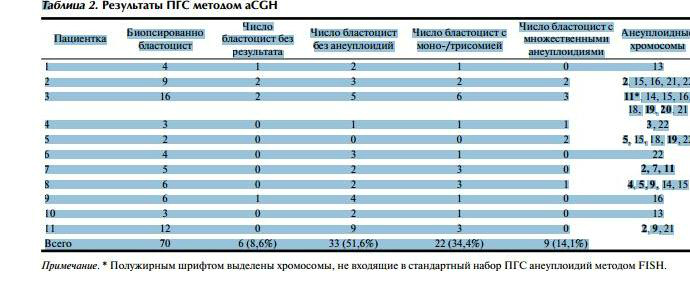
В 6 (8,6%) случаях анализ не проведен вследствие отсутствия амплификации ДНК биопсированного материала. Из 64 проанализированных эмбрионов 33 (51,6%) не имели численных аномалий хромосом, 22 (34,4%) эмбриона имели анеуплоидию по одной из хромосом (моно- или трисомия), у 9 (14,1%) эмбрионов отмечены многочисленные анеуплоидии. Четырем пациенткам выполнен селективный перенос одного размороженного эмбриона после диагностики методом aCGH. В первых двух случаях клиническая беременность подтверждена при ультразвуковом исследовании (УЗИ). Третий перенос - положительный анализ ХГЧ. Результат последнего переноса пока неизвестен. Первый случай беременности - пациентка 40 лет. Клинический диагноз: вторичное бесплодие, эндокринный фактор (гиперпролактинемия, ановуляция), старший репродуктивный возраст. Показанием к проведению предимплантационной диагностики методом CGH явились возраст пациентки и наличие в анамнезе спонтанного выкидыша в сроке беременности 7 нед. Контролируемую овариальную стимуляцию проводили в стандартном длинном протоколе с агонистами ГнРГ (диферелин 0,1 и гонал-Ф). В результате пункции фолликулов получено 15 ооцитов. Диагностика проведена на 9 бластоцистах. Только 3 эмбриона не имели хромосомной патологии. После переноса одного эмбриона наступила прогрессирующая беременность плодом женского пола. В настоящее время проведен УЗИ-скрининг II триместра беременности. Второй случай беременности - пациентка 37 лет. Клинический диагноз: вторичное бесплодие, эндокринный фактор (синдром поликистозных яичников). В анамнезе у пациентки две неразвивающиеся беременности в сроке 5 и 9 нед. Контролируемую овариальную стимуляцию проводили в протоколе с антагонистами ГнРГ (оргалутран, пурегон). В качестве триггера использовали агонист ГнРГ (декапептил). В результате пункции фолликулов получено 43 ооцита. Перенос эмбрионов в лечебном цикле не производили из-за риска развития синдрома гиперстимуляции яичников.У части эмбрионов хорошего качества на 3-й день развития проведена биопсия бластомера с последующей диагностикой методом FISH. По результатам анализа 3 хромосом (X, Y, 21) у 10 (42%) из 24 эмбрионов были выявлены анеуплоидии, 14 (58%) эмбрионов не имели численных отклонений по этим хромосомам и 9 из них достигли стадии бластоцисты и были витрифицированы. Часть эмбрионов, на которых не проводили биопсию бластомера, культивировали до 5-го дня развития. Пять эмбрионов достигли стадии бластоцисты хорошего качества, и на них была проведена биопсия трофэктодермы с последующей aCGH. Первый перенос размороженных эмбрионов проводили с использованием эмбрионов, диагностированных методом FISH. Для переноса были взяты 2 эмбриона хорошего качества, однако беременность не наступила. По результатам aCGH только 2 эмбриона не имели хромосомной патологии. Один из них был перенесен в следующем цикле. На 4-й неделе после переноса биохимическая беременность была подтверждена клинически. При проведении ПГС методом FISH на эмбрионах 3-го дня развития в нашей клинике проводится анализ хромосом 13, 14, 15, 16, 18, 21, 22, X, Y - наиболее часто встречающихся анеуплоидий , при наличии которых возможно рождение ребенка с генетической патологией, а также хромосомной патологии, наиболее часто встречающейся при неразвивающихся беременностях. Однако по результатам метода aCGH, 14 эмбрионов были анеуплоидными по другим хромосомам, и данные эмбрионы не были бы исключены при использовании стандартной методики
FISH и могли быть взяты для переноса, что снизило бы результативность применения программ ВРТ.В дальнейшем планируется накопление и анализ собственных данных.При внедрении методики в хорошо оснащенной
лаборатории, с высокими показателями результативности можно предполагать повышение эффективности программ ВРТ в группах пациенток старшего репродуктивного возраста, пациенток с несколькими предыдущими неудачными попытками ЭКО, а также при носительстве сбалансированных структурных хромосомных аномалий.
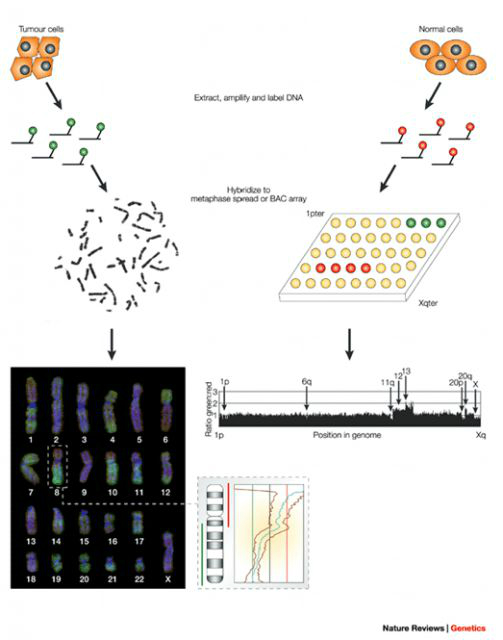
В настоящее время кариотипирование единичных бластомеров или клеток трофэктодермы проводят с помощью сравнительной геномной гибридизации генетического материала, получаемого из этих клеток эмбриона на ранних стадиях его развития, на микрочипе (по-английски Array-based Comparative Genomic Hybridization - aCGH). Микрочип представляет собой миниатюрное стекло (идентичное по размерам обычному предметному стеклу для микроскопа), на которое в строго определенном порядке нанесены фрагменты ДНК различных участков всех хромосом человека. Генетический материал, полученный из исследуемого эмбриона, фрагментируют и метят специальными флуоресцентными красителями, позволяющими впоследствии легко детектировать ДНК. После этого проводят гибридизацию исследуемой ДНК с микрочипом, т. е. с теми фрагментами нормальной ДНК, которые нанесены на него.
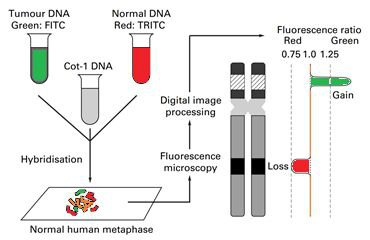
После этого, зная соответствие каждого микрометра поверхности микрочипа определенному фрагменту определенной хромосомы, можно судить о копийности этого локуса в исследуемом образце. Таким образом, проводится анализ потери или наличия лишних хромосом (анэуплоидий), крупных хромосомных перестроек (делеций, дупликаций).
Однако мало кто знает, что столь мощный и высокоразрешающий метод, как aCGH, был разработан и применяется в клинической практике не так давно. Первоначально сравнительная геномная гибридизация заключалась в сравнении паттерна гибридизации меченой ДНК, выделенной из исследуемого биологического образца, с меченной другой краской ДНК, выделенной из нормального контрольного образца, на препарате метафазных хромосом [3]. В норме фрагменты ДНК из исследуемого и контрольного образцов равномерно покрывают окрашенный ими препарат метафазных хромосом, которые в таком случае окрашиваются смешанных цветом. Если в исследуемом образце имеется крупная делеция какого-либо участка (или всей) хромосомы, на метафазных хромосомах в этом месте будет гибридизоваться только контрольная ДНК, что приведет к окраске этого локуса только одной краской, соответствующей нормальной ДНК. Если же какой-то локус (или целая хромосома) окрашен только краской, соответствующей исследуемому образцу, это свидетельствует о том, что данный локус дуплицирован в исследуемом образце или же что имеет место лишняя хромосома.
Понятно, что разрешающая способность, т. е. и способность детектировать небольшие перестройки хромосом, метода сравнительной геномной гибридизации на метафазных хромосомах не высока, и с его помощью можно «разглядеть» лишь очень крупные перестройки или диагностировать существенные изменения в кариотипе, как-то: потеря или приобретение целой хромосомы или ее большой части (например, целого плеча).
Разрешающая способность a-CGH (array Comparative Genomic Hybridization), выполняемой на микрочипах, значительно выше. Однако следует различать СГГ, как метод молекуляроного кариотипирования, и как метод детекции анэуплоидий (неправильного числа хромосом). Максимальная чувствительность метода требуется, например, для установления генетической причины заболеваний, сопряженных с делециями, у больных детей. Также сложные случаи пренатальной диагностики, когда нужно установить причину врожденных пороков развития плода, требует СГГ высокого разрешения (молекулярного кариотипирования). С другой стороны, в практике ПГД - преимплантационной генетической диагностики - используется вариант СГГ с меньшим разрешением. Дело в том, что в геноме человека возможно бесконечное количество перестроек, и клиническое значение большинства из них неизвестно. Поэтому такие «случайные находки» происходили бы постоянно, но отбраковывать на основании таких данных эмбрион - неправильно. Основная задача преимпланатационного скрининга - отсеять эмбрионы с заведомо патологическими мутациями, такими, как лишняя или недостающая хромосома, и при этом провести анализ на минимально возможном количестве материала, чтобы не снижать жизнеспособность эмбриона.
 Может она наставит на путь истинный и все получится на этот раз
Может она наставит на путь истинный и все получится на этот раз 
 да, и мысли опять наслоятся в очередной раз и вопросов станет еще юольше
да, и мысли опять наслоятся в очередной раз и вопросов станет еще юольше 
 Не забудь парик и черные очки одеть с усами
Не забудь парик и черные очки одеть с усами 



