Долго я зрела на этот пост, наверное год с лишним. Сначала не видела в нем смысла, тк информации в сети про данный деликатный этап в жизни любой женщины огромное количество: медицинские статьи, вебинары гинекологов, блоггеры в соцсетях также вещают про « нынешние 50т это бывшие 40к» и тд. И все же , несмотря на подкованность, к некоторым моментам я не была готова.
Персистирующий фолликул яичника
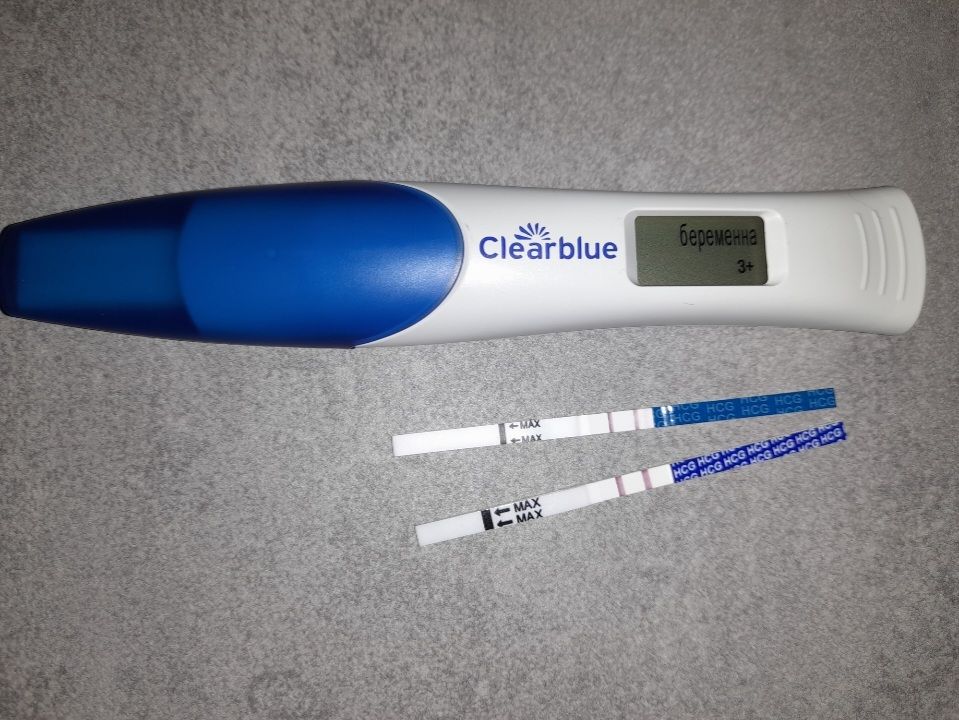
27 марта 2023 года состоялся мой удачный , четвертый по счету криоперенос, который перевернул всю мою жизнь , с ног на голову.
Решила написать как все эт
Привет, девочки.
У меня СПКЯ, 6 недель назад была биопсия ШМ (по ней ничего страшного, эрозия, которую на биопсии же и убрали).
Своей овуляции нет, планируем с репродуктологом стимуляцию. Цикл на утрожестане был 28-30 дней, сейчас не знаю какой будет, так как отменила утрожестан.
Предположительно сегодня 33 ДЦ (
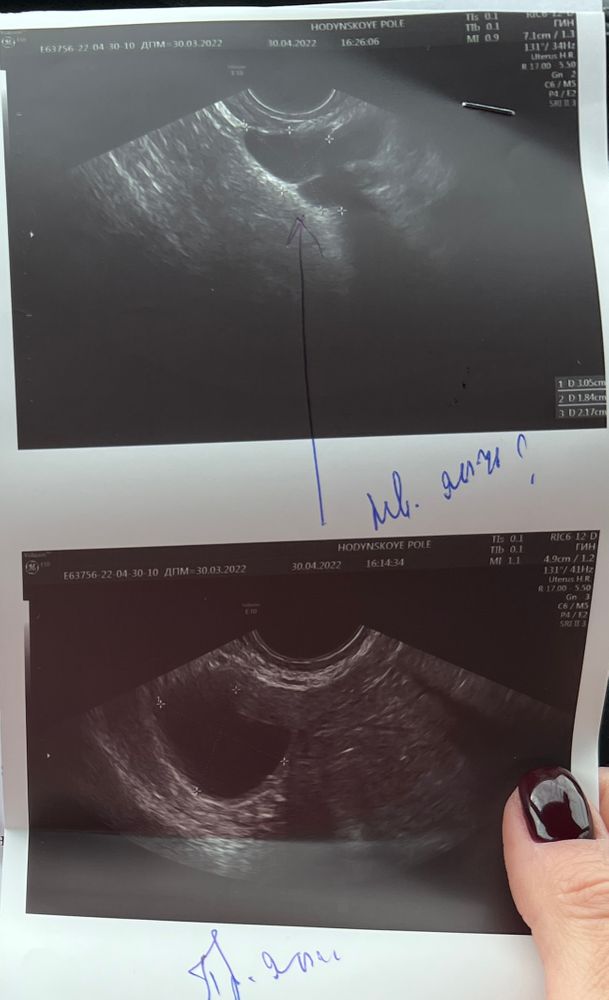
Добрый вечер!
Хочу поинтересоваться у знающих девочек, опытных и частых посетителей узи мониторинга😅 Что вы видите на нижнем фото узи?
А вообще ситуация инт
Доброго вечера, девочки
Ситуация такая: начало цикла 26.11, решила на фолликулометрии поотслеживать рост фолликулов и овуляцию, первое узи в цикле 02.12 это 7 день цикла и узист видит фолликул 12 мм в правом яичнике, подозревает персистенцию и что он с прошлого цикла, то есть овуляции в прошлом цикле ее было (и месячные пришли с задержкой
Девочки,привет) я в шоке. сходила на узи (вобще собиралась на фолликулометрию,но сказали сначала вагинальное сделаем)
вобщем узистка ничего мне толком не сказала.сделала молча узи ,дала распечатку и на этом приём закончился. я пыталась что то распросить но она не особо хотела мне отвечать. помогите разобратся что это такое у меня .единственное что сказала что О уже была,но она не уверена,потому,что жидкости не много вокруг яичника,возможно это воспаление.сказала через неделю надо еще смотреть
на распечатке вот что
_________________________________________
ПРАВЫЙ ЯИЧНИК-вокруг небольшое кол-во жидкости
РАСПОЛОЖЕНИЕ-типичное
РАМЕР-29\20мм
Фолликулярый аппарат
содержит еденичные антральные фолликулы,желтое тело 15\9мм, а так же анэхогенное образование 17 мм в диаметре,со стенкой 0.66мм
_____________
Левй ЯИЧНМК
РАСПОЛОЖЕНИЕ-типичное
РАЗМЕР 29\24мм
фолликулярный аппарат
в толщине яичника определяются еденичные антральные фолликулы а так же желтое тело 14\11мм
оценка результатов исследования:
2 фаза цикла,желтое тело в правом яичнике,персистирующий фоликул в правом яичнике?
как это все понимать? ПОМОГИТЕ!!!
1. Матка, размеры и форма.
На размеры матки влияют не только предшествующие беременности, но и фаза менструального цикла - матка относительно уменьшена в пролиферативную фазу и относительно увеличена в конце секреторной фазы. Размеры матки могут незначительно меняться в зависимости от методики исследования. При ТАИ толщина тела может быть несколько уменьшена за счет сдавления переполненным мочевым пузырем, и напротив, при ТВИ - несколько увеличена за счет повышения тонуса миометрия. Форма матки грушевидная, а после многократных беременностей имеет тенденцию к округлости. Миометрий в норме имеет среднюю эхогенность, сопоставимую с эхогенностью паренхимы неизмененной печени, поджелудочной железы а также коркового слоя почек.
Средние размеры матки:
длина тела матки – 4,4-5,6 см,
толщина тела матки – 3,2-4,3 см,
ширина тела матки – 3,2-5, 5 см.
Размеры шейки матки:
длина шейки матки – 2,8-3,7 см,
толщина шейки матки – 2,6-3,3 см,
ширина шейки матки – 2,9-5,3 см.
В постменопаузе матка постепенно уменьшается в размерах ( с увеличением срока менопаузы).
Длина шейки – 2,9-2,4 см,
Толщина шейки – 2,4-2,1 см,
Ширина шейки - 2,7-2,3 см.
Длина тела матки - 3, 8-3,3 см,
Толщина тела матки - 3,1-2,5 см,
Ширина тела матки – 3,6-3,1 см.
2. Эндометрий.
Ультразвуковую анатомию эндометрия рассматривают применительно к различным фазам менструального цикла при так называемом "идеальном" цикле, длящемся 28 дней, с овуляцией на 14-й день.
Во время менструации в полости матки определяется тонкая гиперэхогенная полоска, либо гиперэхогенные эхоструктуры (сгустки крови). Иногда полость выглядит незначительно расширенной за счет эхонегативного содержимого (жидкая кровь).
На 5-7 дни цикла (фаза ранней пролиферации) - эндометрий имеет относительно низкую эхогенность и однородную эхоструктуру. Толщина колеблется в пределах 3-6 мм, составляя в среднем 5 мм . В центре М-эхо уже в этот период может определяться гиперэхогенная тонкая линия, представляющая границу соприкосновения переднего и заднего листков эндометрия.
На 8-10 дни цикла (фаза средней пролиферации) - эндометрий несколько утолщается - в среднем до 8 мм (колебания 5-10 мм). Эхоструктура по сравнению с предыдущим периодом практически не меняется.
На 11-14 дни цикла (фаза поздней пролиферации) - помимо дальнейшего утолщения, в среднем до 11 мм (колебания 7-14 мм), начинает незначительно повышаться эхогенность эндометрия - на этом этапе ее можно назвать средней.
На 15-18 дни цикла (фаза ранней секреции) - характерен более медленный темп роста эндометрия, однако последний пока продолжает утолщаться, достигая в среднем 12 мм (колебания 10-16 мм). Эхогенность продолжает повышаться, причем это происходит от периферии к центру, в результате гипоэхогенный центральный фрагмент эндометрия принимает каплевидный вид (широкая часть в области дна матки, сужаясь по направлению к шейке). В эту фазу гиперэхогенная линия в центре визуализируется уже нечетко.
На 19-23 дни цикла (фаза средней секреции) - эндометрий достигает максимальной толщины - в среднем 14 мм (колебания 10-18 мм). Эхогенность еще более повышается, гиперэхогенная линия в центре визуализируется плохо.
На 24-27 дни цикла (фаза поздней секреции) - толщина эндометрия чуть уменьшается - в среднем 12 мм (колебания 10-17 мм). Существенной особенностью этого периода является высокая эхогенность эндометрия в сочетании с неоднородной внутренней эхоструктурой, за счет чего линия смыкания листков перестает визуализироваться.
Полость матки в постменопаузе представляет из себя М-эхо в виде тонкой гиперэхогенной линии толщиной 1-2 мм. Допустимой верхней границей нормы в постменопаузе следует считать толщину М-эхо не более 4-5 мм.
При допплерографии матки обращают внимание изменения показателей как скорости, так и резистентности кровотока, причем в зависимости не только от калибра сосуда, но и от фазы менструального цикла. Допплерографическая оценка эндометрия имеет особое значение при поиске гинекологической патологии и должна производиться в раннюю пролиферативную фазу. Важно подчеркнуть отсутствие визуализации внутриэндометриального кровотока в этот период.
При допплерографическом исследовании в постменопаузе в норме интраэндометриальный кровоток не визуализируется.
3. Яичники
Яичники обычно располагаются на боковых стенках таза в так называемых яичниковых ямках - углублениях париетальной брюшины у места деления общей подвздошной артерии на наружную и внутреннюю. Эхографически их можно визуализировать в основном сбоку от матки, но нередко они определяются кзади от нее или примыкают к одному из маточных углов. Как уже указывалось, при затруднениях в поиске яичника анатомическими ориентирами могут служить расположенные в непосредственной близости внутренние подвздошные артерия и вена. В норме яичники хорошо подвижны и достаточно легко смещаются при надавливании трансвагинальным датчиком. Форма яичника овоидная и сплюснутая спереди назад. В репродуктивном возрасте эхографические размеры яичников колеблются в значительных пределах, причем это в большой степени зависит от целого ряда факторов: возраста, репродуктивного анамнеза, фазы менструального цикла, приема оральных контрацептивов и т.д.
Размеры яичников:
Длина – 20-37 мм,
Толщина – 16-22 мм,
Ширина – 18-30 мм,
Объем – 4,0-10,0 см3.
Размеры правого и левого яичников в фазе ранней пролиферации почти одинаковы, однако затем они могут существенно отличаться в зависимости от количества и размеров антральных и доминантного фолликулов, а также желтого тела. Таким образом, для выявления патологического увеличения яичников исследование должно проводиться на 5-7 дни менструального цикла, при этом решающим следует считать определение не линейных размеров, а объема, который в норме не превышает 10 см3.
Внутреннюю анатомию яичника, так же как и матки, целесообразно рассматривать применительно к различным фазам менструального цикла.
Строма яичника, представляющая соединительно-тканную основу коркового вещества, эхографически визуализируется как зона средней эхогенности, преимущественно расположенная в центральных отделах яичника.
Корковое вещество яичника содержит фолликулы различной степени зрелости (фолликулярный аппарат). Многочисленные (сотни тысяч) примордиальные, первичные, и вторичные фолликулы не определяются при эхографии, поскольку их размеры не превышают 400 мкм.
На 5-7 дни цикла (фаза ранней пролиферации или ранняя фолликулярная фаза) визуализируемую часть фолликулярного аппарата представляют в основном 5-10 третичных, или антральных фолликулов. Последние имеют вид округлых эхонегативных включений диаметром 2-6 мм, расположенных преимущественно по периферии яичника. Сеть спиральных сосудов вокруг развивающегося фолликула возникает уже в начале антральной фазы. При этом кровоток визуализируется в виде немногочисленных цветовых локусов в строме и по периферии антральных фолликулов
На 8-10 дни цикла (средняя пролиферация или средняя фолликулярная фаза) обычно появляется доминантный фолликул, диаметр которого уже составляет 12-15 мм и продолжает увеличиваться, в то время как рост других фолликулов останавливается, и они достигнув 8-10 мм в диаметре, подвергаются атрезии (что эхографически определяется в постепенном уменьшении и исчезновении к концу менструального цикла). Кровоснабжение доминантного фолликула обычно происходит за счет двух-трех стромальных артерий, как правило, визуализируемых по периферии, или даже в стенке последнего. При этом допплерометрические показатели стромальных артерий и артерий доминантного фолликула достоверно не отличаются.
На 11-14 дни цикла (фаза поздней пролиферации или поздня фолликулярная фаза) доминантный фолликул увеличивается на 2-3 мм в день, достигая к моменту овуляции 18-25 мм (в среднем 20 мм). К прогностическим признакам овуляции, свидетельствующим о том, что последняя произойдет в ближайшие несколько часов, относятся: диаметр доминантного фолликула 18 мм, двойной контур вокруг последнего, а также фрагментарное утолщение и неровность внутреннего контура доминантного фолликула. Васкуляризация доминантного фолликула становится субъективно более заметной по сравнению с другими фолликулярными структурами тоже только накануне овуляции.
О произошедшей овуляции эхографически можно судить по исчезновению доминантного фолликула или уменьшению его размеров с деформацией стенок и появлением эхогенного содержимого в полости, а также появлению жидкости в дугласовом пространстве.
На 15-18 дни цикла (фаза ранней секреции или ранняя лютеиновая фаза) характерно появление в месте овуляции желтого тела диаметром 15-20 мм (обычно меньше доминантного фолликула), имеющим неправильную форму, неровные контуры, и чрезвычайно разнообразную внутреннюю эхоструктуру различной степени эхогенности. Этот своеобразный эхографический полиморфизм легко объясним морфологическим субстратом ядра желтого тела, представляющего собой кровяной сгусток в различной степени тромбообразования и лизиса.
На 19-23 дни цикла (фаза средней секреции или средняя лютеиновая фаза) для "цветущего" желтого тела характерно некоторое увеличение диаметра (до 25-27 мм), а также появление неравномерно утолщенного эхопозитивного валика. Эхогенность содержимого за счет лизиса может постепенно понижаться вплоть до формирования "кистозного" желтого тела.
В течение первых же дней после овуляции вокруг желтого тела формируется плотная, многослойная сосудистая сеть, особенно выраженная в фазу расцвета. На цветовых допплерограммах вокруг желтого тела появляется выраженное цветовое кольцо, кровоток в котором отличается высокими значениями скорости и низким импедансом. Это типично для бурной физиологической неоваскуляризации.
На 24-27 дни цикла (фаза поздней секреции или поздняя лютеиновая фаза) "угасающее" желтое тело уменьшается в размерах (10-15 мм), его эхогенность несколько повышается, а эхоструктура становится более однородной. При этом желтое тело эхографически нередко начинает плохо визуализируется. При отсутствии беременности кровоснабжение желтого тела начинает меняться приблизительно к 9 дню после овуляции. Ткань желтого тела начинает подвергаться лютеолизу, капилляры сокращаются и редуцируются, что характеризуется заметным обеднением местного кровотока.
Во время менструации желтое тело уже, как правило, не определяется, либо на его месте сохраняется нечеткая эхоструктура повышенной эхогенности диаметром 2-5 мм (белое тело), которое обычно бесследно исчезает в течение следующего менструального цикла. Доказано, что не проходящее белое тело в виде рубца сохраняется только после гравидарного желтого тела. Циркуляция крови в сосудах исчезающего желтого тела прекращается, а сами сосуды исчезают в течении первых трех дней менструации.
Результаты исследований допплерометрических показателей интраовариального кровотока, проведенных многими авторами, а также наши собственные данные демонстрируют существенные циклические изменения показателей скорости и периферической резистентности интраовариального кровотока в овулирующем яичнике в различные фазы менструального цикла.
В постменопаузе яичники существенно уменьшаются, при этом размеры правого и левого яичника должны быть практически одинаковыми.
Длина яичника – 25-20 мм,
Толщина яичника – 12-9 мм,
Ширина яичника – 15-12 мм,
Объем яичника – 4,5-1,5 см3.
Следует подчеркнуть, что показатели, превышающие границы возрастной нормы, а также разница в объемах правого и левого яичников более 1.5см3 являются признаками патологии. Асимметричное увеличение одного из яичников более чем в два раза следует считать маркером малигнизации.
В течение постменопаузального периода фолликулярный аппарат постепенно подвергается практически полной редукции. Первые 5 лет после менопаузы в паренхиме яичника "имеют право" визуализироваться единичные фолликулы диаметром <10 мм. В последующем яичники выглядят как образования овальной формы, эхоструктура которых характеризуется достаточно однородной средней эхогенностью. Мы убеждены, что после 5-ти лет постменопаузы визуализация в яичниках персистирующих кистозных включений любых размеров должна рассматриваться как патология.
Интраовариальная перфузия в постменопаузе крайне незначительна. Если в первые 5 лет единичные цветовые локусы еще выявляются как при цветовой, так и при энергетической допплерографии, то уже в следующие 5 лет постменопаузы цветовая допплерограмма обычно полностью ахроматична и выявить кровоток можно только с помощью энергетической допплерографии. После 10 лет постменопаузы интраовариальный кровоток, как правило, не визуализируется даже при использовании энергетической допплерографии.
На размеры матки влияют не только предшествующие беременности, но и фаза менструального цикла - матка относительно уменьшена в пролиферативную фазу и относительно увеличена в конце секреторной фазы. Размеры матки могут незначительно меняться в зависимости от методики исследования. При ТАИ толщина тела может быть несколько уменьшена за счет сдавления переполненным мочевым пузырем, и напротив, при ТВИ - несколько увеличена за счет повышения тонуса миометрия. Форма матки грушевидная, а после многократных беременностей имеет тенденцию к округлости. Миометрий в норме имеет среднюю эхогенность, сопоставимую с эхогенностью паренхимы неизмененной печени, поджелудочной железы а также коркового слоя почек.
Привет мои дорогие!!!
небольшое отклонение:
Вот и наступил тот момент когда я снова захотела ощутить все "прелести" беременности!!!
Я действительно этого захотела, причем с невероятно страшной силой!!!
Когда беременность не наступает...
Фолликулогенез - циклический процесс, протекающий в яичниках под контролем нервной и эндокринной системы. Основным механизмом его является трансформация и преобразование фолликула в зрелую яйцеклетку.
Роль антимюллерова гормона (АМГ) в норме и при различных гинекологических заболеваниях
Введение
Антимюллеров гормон (АМГ), другие названия - антимюллеровская субстанция или антимюллеровый фактор, является одним из наиболее интересных маркеров репродуктивной системы женщины, появившихся за последние годы. Измерение этого нового яичникового нестероидного гормона позволило изучить более глубокие процессы роста и созревания фолликулов и выяснить отдельные вопросы патогенеза ряда гинекологических заболеваний. В отечественной литературе роли АМГ в норме и патологии яичников посвящены пионерские работы профессора Орлова В.М. (Санкт-Петербург) (1,2) и профессора Назаренко Т.А. (Москва) (5).
Роль АМГ в мужском и женском организмах.
Немецкий анатом Йохан Мюллер (1801 - 1858) описал эмбриональный проток, предшественник матки, маточных труб и верхней трети влагалища. Этот проток получил название мюллерова. Другой немецкий и российский анатом Каспар Вольф (1733 - 1794) описал проток, предшественник семявыводящих путей, эпидидимиса и семенных пузырьков. Этот проток получил название вольфова.
Во время эмбрионального развития в мужском организме на сроке 8-10 недель мюллеров проток рассасывается. В середине ХХ века были произведены эксперименты, которые показали, что эмбриональное яичко выделяет субстанцию, которая способна вызывать рассасывание мюллерова протока. Это вещество получило название антимюллеров гормон (АМГ) (67). Физиологическая функция данного гормона различается в мужском и женском организме. В мужском организме в фетальный период формирующиеся клетки Лейдега продуцируют тестостерон, под воздействием которого развивается вольфов проток. Клетки Сертоли продуцируют АМГ, что вызывает регрессию мюллерового протока. В мужском организме АМГ выделяется клетками Сертоли с высокой интенсивностью в течение фетального периода и в детстве, однако уровень экспрессии снижается когда половые клетки в яичках начинают процесс мейоза, в пубертатный период, и во взрослом возрасте.
Долгое время функция АМГ в женском организме была неизвестна. Это связано с тем, что этот гормон могут вырабатывать только клетки гранулезы фолликулов от преантральной стадии до стадии больших антральных. В яичниках девочки первые признаки продукции АМГ появляются в пренатальный период (32 - 36 недель беременности) и уровень этого гормона в крови медленно повышается с возрастом. Максимума уровень АМГ достигает к расцвету репродуктивной функции женщины в 20 - 30 лет, после чего постепенно снижается и к менопаузе равняется нулю. В мужском организме АМГ в фетальный период достигает максимума после 8 недели беременности - 105 нг/мл, после чего постепенно уменьшается, достигая низких величин после 40 лет (14).
Молекулярно-биологические характеристики АМГ
АМГ человека представляет собой димерный гликопротеин с молекулярным весом 140 кДа, при активации от него отделяется биологически активный фрагмент весом 25 кДа (15). Ген этого гормона у человека находится на хромосоме 19 p13.3- p13.2 (11). АМГ относится к гликопротеинам, относящимся к суперсемейству трансформирующего фактора роста бета (ТФР-β). Кроме АМГ к регуляторам функции яичников, относятся также члены этого суперсемейства: BMP - 4, BMP - 8, BMP - 15, CDF - 9, ингибины А и B (10).
Коммерческие определители уровня АМГ.
Ряд фирм производит коммерческие определители уровня АМГ в крови, основанные на энзим-связанном иммуносорбентном методе (ELISA). Обычно используют определители фирм Medgenix, Serotec, Bayer, Immunotech-Coulter. Современные методы позволяют определить уровень АМГ от 0,01 нг/мл. При указании уровня в пмолях на литр коэффициент пересчета составляет 7,14 пмоль/л = 1 нг/мл.
В связи с клиническим использованием определения уровней АМГ встал вопрос о нормальных значениях этого гормона. Для определения нижнего порогового значения АМГ в диагностике овариального резерва обычно используют уровень от 0,2 до 0,5 и даже 1,0 нг/мл. Для определения верхнего значения обычно используют уровень 11 нг/мл и более высокие значения могут говорить о возможном наличии гранулезо- клеточной опухоли яичников (см. ниже).
Роль АМГ в фолликулогенезе.
Роль АМГ в фолликулогенезе разнообразна и до конца не изучена. Эксперименты на мышах, с выключенной функцией АМГ, показали, что у таких животных скорость входа примордиальных фолликулов в число растущих увеличена. Авторы этого исследования считают, что АМГ может защищать примордиальные фолликулы от выхода из покоящегося состояния (16). Недавно было найдено подтверждение подобного механизма у человека. Были описаны женщины с уменьшенной активностью АМГ, которая объяснялась полиморфизмом в гене рецептора к АМГ второго типа (AMH-RII). У таких женщин менопауза наступала раньше, чем в популяции (31).
В яичниках человека АМГ вырабатывается от пренатального периода до менопаузы. Этот гормон выделяется клетками гранулезы растущих фолликулов, от преантральной стадии вплоть до размера антральных фолликулов 6-8 мм в диаметре. После достижения фолликулов размера 8 мм и более уровень АМГ резко падает и возрастает активность ароматазы и, соответственно, продукция эстрадиола. Имеется четкое обратное взаимодействие между продукцией гранулезой предоминантного фолликула эстрадиола и АМГ (8). Также было отмечено, что доминантные и атретические фолликулы содержат крайне низкие уровни АМГ(75). У пациенток с полиморфизмом в гене рецептора к АМГ (AMH-RII) и уменьшенной функцией этого гормона наблюдается более быстрый рост доминантного фолликула (30).
Эти исследования говорят о том, что АМГ характеризует фолликулы на стадии предшествующей гормон -зависимому периоду роста фолликулов и сам АМГ защищает гранулезу растущих фолликулов от избыточного митогенного влияния ФСГ. Это позволяет получить информацию о более глубоких процессах фолликулогенеза и оценить число растущих фолликулов на гормон-чувствительной стадии роста (3).
Уровень АМГ в течение менструального цикла женщины остается постоянным и не сильно зависит от колебаний гипофизарных гонадотропинов, половых стероидов и ингибинов (28, 36). Одиночное измерение АМГ, на любой день менструального цикла дает полную клиническую информацию о состоянии овариального резерва (34). Wunder et al. тщательно изучили колебания АМГ в течение менструального цикла женщины с помощью особо чувствительного набора, способного определять уровни АМГ порядка 0,01 нг/мл. Было обнаружено, что АМГ подвержен небольшим, но статистически значимым колебаниям. Наибольшего значения АМГ достигает за четыре дня до овуляторного пика ЛГ, после чего снижается до минимума на четвертый день после пика ЛГ. После этого уровень АМГ повышается в течение первой половины лютеиновой фазы цикла и остается относительно стабильным в течение поздней лютеиновой фазы вплоть до середины фолликулярной фазы следующего цикла (77).
Изменение уровня АМГ с возрастом женщины.
АМГ является важнейшим показателем старения женской репродуктивной системы . Van Rooij et al. исследовали 81 здоровую женщину в возрасте 25-46 лет с целью изучить изменение таких показателей старения яичников, как число антральных фолликулов (ЧАФ), уровень АМГ, базальные уровни ФСГ, ингибина В и эстрадиола. Все женщины были исследованы дважды, с промежутком в 4 года. Выяснилось, что у женщин любого возраста уровень АМГ и ЧАФ имели корреляцию с возрастом, тогда как базальные уровни ФСГ и ингибина В имели такую корреляцию только у пациенток после 40 лет, а уровень эстрадиола вообще не имел такой корреляции. Уменьшение уровня АМГ было лучшим показателем старения яичников, вторым после него авторы считают уменьшение ЧАФ. Базальные уровни ФСГ и ингибина В авторы считают показателями старения яичников средней степени достоверности, а уровень эстрадиола как не имеющим значения (73).
Группа ВОЗ по изучению менопаузы в 1980 году ввело ряд определений. Под "естественной менопаузой" понимается прекращение месячных из-за потери фолликулярной активности яичниками. Естественная менопауза возникает после 12 месяцев аменореи, когда нет другой причины для ее возникновения. Под "переходом к менопаузе" понимают период между началом нарушения менструального цикла и последними месячными. (58,76). Более подробно стадии репродуктивного старения (STRAW) рассмотрела группа исследователей Американского общества репродуктивной медицины под руководством профессора Майкла Саулеса (63). Было предложено разделить репродуктивный период женщины на три фазы: раннюю, пик и позднюю. Переход к менопаузе - на ранний и поздний. Постменопаузу - на раннюю и позднюю. Уровень ФСГ растет, начиная с позднего репродуктивного периода, достигая максимума в раннюю постменопаузу. Продолжительность менструального цикла начинает быть подвержена колебаниям во время ранней стадии перехода к менопаузе, затем нарушения становятся более выраженными и наконец, после отсутствия месячных более 12 месяцев можно поставить диагноз "менопауза" (63).
Hale G. et al. подробно изучили уровни гормонов в крови пациенток согласно классификации STRAW. Выяснилось, что самым ранним маркером, показывающим переход от пика репродуктивной функции к позднему репродуктивному периоду, является падение уровня АМГ в десять раз, с 3,9 + 2,3 нг/мл до 0,32 + 0,24 нг/мл. В тоже время такие показатели как увеличение базального уровня ФСГ, падение базального уровня ингибина В гораздо менее выражены, а уровень прогестерона в середине лютеиновой фазы цикла остается неизмененным. Все это говорит о роли АМГ как перспективном маркере уменьшения репродуктивной функции женщины с возрастом.
С приближением менопаузы отмечается дальнейшее падение уровня АМГ. В ранний и поздний период перехода к менопаузе уровень этого гормона составляет 0,15 + 0,2 и 0,06 + 0,08 нг/ мл, соответственно. В постменопаузу уровень этого гормона равен нулю. Авторы делают выводы об АМГ, как наиболее чувствительном маркере старения яичников у человека (26)
Группа голландских исследователей на основе популяционного исследования создали модель, которая может предсказывать возможное время наступления менопаузы по одиночному измерению АМГ. В этой работе представлена таблица, согласно которой можно предсказать возможное время наступления менопаузы. Так, если у женщины в 37 лет наблюдается низкий уровень АМГ- 0,3 нг/мл, то возможное время наступления менопаузы у такой женщины составляет 41-44 года, что на 7-10 лет раньше, чем в популяции (51 год). И наоборот, если у женщины в 42 года наблюдается высокий уровень АМГ - 2 нг/мл, то время наступления менопаузы у этой женщины должно составлять 51-53 года, что на 2 гола позже, чем в среднем по популяции (71).
Американские исследователи изучили уровни базального ингибина В и АМГ у женщин в течении 5 лет до наступления менопаузы и выяснили, что крайне низкие уровни обоих гормонов являются достоверными маркерами, предсказывающими время наступления последних месячных, однако АМГ является более достоверным показателем (64).
Роль АМГ в определении овариального резерва.
Под овариальным резервом понимают функциональный резерв яичника, который определяет способность последнего к развитию здорового фолликула с полноценной яйцеклеткой и адекватному ответу на овариальную стимуляцию. Овариальный резерв отражает количество находящихся в яичниках фолликулов (примордиальный пул и растущие фолликулы) и зависит от физиологических и патофизиологических факторов(4) .
Впервые измерение АМГ как метод определения овариального резерва был предложен Seifer D. et al. в 2002 году. Авторы обнаружили, что у пациенток с числом полученных ооцитов 6 и менее, по сравнению с пациентками, у которых было получено 11 и более ооцитов, статистически различаются уровни АМГ, измеренного перед началом стимуляции, 1,0 + 0,4 нг/мл и 2,5 + 0,3 нг/мл, соответственно (59).
Назаренко Т.А. с соавт. исследовали АМГ у 30 здоровых женщин и у 210 пациенток с бесплодием. Авторы выявили, что у пациенток с трубно перитонеальным фактором имелась тенденция к увеличению доли женщин с низкими показателями АМГ. Авторы делают вывод о применимости измерения АМГ как показателя овариального резерва (5).
Van Rooj. et al. тщательно изучили клиническое значение определения АМГ в программе ЭКО. Выяснилось, что уровень АМГ имеет корреляцию с возрастом пациентки ( R = -0,30, Р < 0,01), с базальным уровнем ФСГ (R = 0,54, P < 0,01), с базальным уровнем ингибина В (R= 0,32, P < 0,01), с числом антральных фолликулов (ЧАФ) (R=0,77, P < 0,01) и с числом полученных ооцитов (R = 0,57, P < 0,01). При логистическом регрессионном анализе влияния АМГ на частоту плохого ответа на стимуляцию (наличие менее 4 полученных ооцитов) выяснилось, что уровень АМГ определял статистически достоверно вероятность этого состояния, независимо от уровня ФСГ и ингибина В (74). Fanchin R. et al. установили, что уровень АМГ имеет более выраженную корреляцию с числом антральных фолликулов, чем остальные гормональные тесты определяющие овариальный резерв (базальные уровни ФСГ, ЛГ, ингибина В и эстарадиола) (20). Hazout A. et al. обнаружили статистически значимое различие в уровне АМГ в группе пациенток, у которых наступила беременность в результате ЭКО и тех у которых беременность не наступила. В группе беременных уровень АМГ составил 2,4 + 0,9 нг/мл, в группе небеременных - 1,1 + 0,6 нг/мл, P < 0,002. В тоже время возраст, базальные уровни ФСГ, ЛГ, ингибина В и эстрадиола не различались в обеих группах пациенток (27). Muttukrishna S. et al. изучили влияния АМГ как маркера плохого ответа, который авторы определили как наличие менее, чем 4 фолликулов 15 мм в диаметре, после проведения стимуляции яичников в программе ЭКО. Выяснилось, что АМГ является главным фактором, который может определять вероятность плохого ответа и включение в анализ базальных уровней ФСГ и ингибина В не дают дополнительную клиническую информацию (46). Группа французских исследователей выявила, что уровень АМГ мало подвержен колебаниям при измерении в разных менструальных циклах одной женщины, по сравнению с другими показателями овариального резерва, базальными уровнями ФСГ, ингибина В, эстрадиолом и числом антральных фолликулов (57).
Ebner T. et al. обнаружили, что уровень АМГ может быть фактором, определяющим не только число ооцитов, полученных в программе ЭКО, но и их качество, т.е. отсутствие центральной темной грануляции и агрегации гладкого эндоплазматического ретикулума. Было показано, что пациентки с высоким уровнем АМГ имеют более высокую вероятность получить ооциты хорошего качества, чем пациентки с низким уровнем этого гормона. Уровни базального ФСГ не определяли качество ооцитов. В то же время частота оплодотворения и развитие эмбрионов до стадии бластоцисты не зависели от уровня АМГ (17).
Группа американских исследователей изучала влияние измерения уровня АМГ у пациенток старшей возрастной группы, проходящих лечение методом ЭКО. Пациентки 37 лет и старше были разделены на 3 группы. В первую вошли женщины, у которых цикл стимуляции яичников был отменен из-за неудовлетворительного ответа. Во вторую вошли пациентки, у которых были получены ооциты в результате стимуляции. В третью группу вошли пациентки. Которым было отказано в лечении из-за высокого уровня базального ФСГ (более 15 мЕд/Л). Выяснилось, что уровень АМГ был статистически выше у пациенток с полученными ооцитами (1,1 + 0,2 нг/мл) и фактически не различался у пациенток с плохим ответом на стимуляцию яичников (0,20 + 0,03 нг/мл) и теми у которых наблюдался высокий уровень ФСГ (0,15 + 0,07 нг/мл). Другие клинические показатели, такие как возраст, базальные уровни ФСГ, ЛГ и эстрадиола не различались в трех группах (47).
Согласно данным британских исследователей уровень АМГ является значимым прогностическим фактором не только для отсутствия ответа на овариальную стимуляцию, но и для чрезмерного ответа на препараты ФСГ. Более того, было показано, что АМГ может предсказывать вероятность рождения живого ребенка после лечения методом ЭКО. Авторы подчеркивают, что измерение уровня АМГ может помочь в подборе индивидуальной дозы ФСГ при стимуляции суперовуляции (50).
Австралийские исследователи показали, что у пациенток с низким уровнем АМГ (менее 2 нг/мл) наблюдалась более низкая частота оплодотворения ооцитов, чем у женщин с высоким уровнем этого гормона, причем вне зависимости от способа оплодотворения - стандартного ЭКО или интрацитоплазматической инъекции сперматозоида в яйцеклетку. У пациенток с низким уровнем АМГ наблюдалось меньшее число полученных ооцитов, меньшее число полученных эмбрионов и более высокая частота выкидышей в сроке до 12 недель, что в общем приводило к тому, что частота беременности на сроке более 12 недель была в два раза выше у пациенток с высоким уровнем АМГ (выше 2 нг/мл), чем у пациенток с низким уровнем гормона (40). Kwee J. et al. сравнили однократное измерение уровня АМГ с определением овариального резерва с помощью гормональных тестов с нагрузкой (теста с нагрузкой кломифенцитратом - (ТНКЦ) и тестом с нагрузкой экзогенным ФСГ- (ТЭФСГ)). Несмотря на то, что ТНКЦ и ТЭФСГ, были лучшими показателями для предсказания вероятности беременности после процедуры ЭКО, авторы считают одиночное определение АМГ наиболее применимым методом оценки овариального резерва в клинической практике (33).
Nardo L. et al. изучали клиническое значение измерения уровня АМГ по сравнению с базальным уровнем
ФСГ и числом антральных фолликулов. Авторы делают вывод, что измерение уровня АМГ может помочь как в прогнозе плохого ответа на овариальную стимуляцию, так и чрезмерного ответа, что делает измерение данного гормона привлекательным в плане индивидуального планирования лечения в программе ЭКО. Число антральных фолликулов и базальный уровень ФСГ не обладают схожей с АМГ клинической значимостью (48).
Fraisse T. et al. описали 2 случая спонтанной беременности у женщин 29 лет и 41 года со вторичным бесплодием и уровнем АМГ не определяемым стандартными методиками - менее 0,4 нг/мл (24). Эти данные говорят о необходимости разработки более чувствительных методов определения АМГ и изучении более тонких механизмов фолликулогенеза. Однако строить клинические рекомендации для программ ЭКО на двух наблюдениях спонтанных беременностей не стоит, так как у пациенток с крайне низкими уровнями АМГ наблюдается крайне низкая частота наступления беременности как при применении стимуляции с высокими стартовыми дозами ФСГ, так и при использовании модифицированного естественного цикла (51).
Nelson S. et al. использовали уровень АМГ, как фактор, определяющий выбор схемы для стимуляции в ЭКО. У пациенток с низким уровнем АМГ (от 0,14 до 0,7 нг/мл) была применена схема овариальной стимуляции с применением антагонистов и высоких стартовых доз ФСГ (300 мЕд). У этой группы пациенток частота отмены цикла из-за отсутствия ответа на стимуляцию составила 8,2% и частота наступления беременности на начатый цикл - 14,7%. У пациенток с уровнем АМГ от 0,7 до 2,1 нг/мл был применен длинный протокол с применением препаратов агонистов люлиберина и ежедневной дозой ФСГ 225 - 300 мЕд. В этой группе пациенток не было отмечено случаев плохого ответа на овариальную стимуляцию и синдрома гиперстимуляции яичников (СГЯ) и частота наступления беременности на начатый цикл составила 32,9%. В группе пациенток с уровнем АМГ более 2,1 нг/мл применялся протокол с антагонистами и дозой ФСГ 150 мЕ в день. В данной группе пациенток у двух (6%) наблюдался плохой ответ на овариальную стимуляцию, однако не было отмечено случаев СГЯ. Частота наступления беременности на начатый цикл составила 61,7%. Авторы делают вывод о большом клиническом значении определения уровня АМГ в плане индивидуального ведения пациенток и уменьшении вероятности таких осложнений как плохой ответ на стимуляцию яичников и СГЯ. Для пациенток с высокими рисками уменьшенного и чрезмерного ответа на стимуляцию авторы предлагают использовать схемы с антагонистами люлиберина и высокими или низкими начальными дозами ФСГ (51).
АМГ и синдром гиперстимуляции яичников
Уровень АМГ может быть важным прогностическим фактором, определяющим вероятность развития такого грозного осложнения овариальной стимуляции, как СГЯ. Было показано, что у пациенток с уровнем АМГ выше 7 нг/мл отмечается крайне высокая частота СГЯ и именно у этой группы пациенток возникает необходимость прекращать стимуляцию или замораживать все эмбрионы в виду развития СГЯ тяжелой степени (34). Lee T. et al. определили, что пороговым значением для риска развития СГЯ является уровень АМГ выше 3,36 нг/мл. При включении в логистический регрессионный анализ выяснилось, что уровень АМГ может предсказывать возможность развития СГЯ более достоверно, чем возраст пациентки и росто-весовой индекс. Уровень эстрадиола на день назначения овуляторной дозы ХГЧ тоже имеет клиническое назначение, но имеет ограниченное значение в плане профилактики данного осложнения (39). Измерение АМГ может служить важным фактором в подборе дозы ФСГ у пациенток с риском СГЯ.
АМГ и синдром поликистозных яичников (СПКЯ)
Современные международные диагностические критерии включают в себя следующие признаки: во-первых, наличие ановуляции, которая выражается в олигоменореи или аменореи, во-вторых, в признаках гиперандрогении яичникового генеза, которая выражается клинически (наличие гирсутизма) или по изменению биохимических показателей (повышение уровней андрогенов) и, в-третьих, в морфологических признаках мульфолликулярных яичников (определяется при ультразвуковом исследовании). Наличие двух из этих трех признаков является современным диагностическим критерием СПКЯ (68). Согласно современным представлением о патогенезе этого синдрома, причиной его является нарушение резистентности к инсулину, что сопровождается повышенным выделением клетками теки и гранулезы растущих фолликулов андрогенов, что в свою вызывает остановку роста фолликулов на стадии, предшествующей селекции доминантного, 4 - 10 мм в диметре. Недавно была предложена теория, объясняющая сочетание инсулинрезистентности и гиперандрогении. Активация в серин киназной системе приводит к фосфориляции рецептора к инсулину и инактивации субстрата инсулинового рецептора - 1 (IRS-1), которая в свою очередь ведет к резистентности к действию этого гормона. Одновременно активация этой же киназной системы приводит к фосфорилированию цитохрома P450c17, которая ведет к гиперандрогении (7).
Многие исследования показывают, что при СПКЯ уровень АМГ в крови повышен в 2-3 раза (12,54). Также показано, что уровень АМГ в крови имеет положительно корреляцию с такими гормональными маркерами наличия СПКЯ, как уровни тестостерона, андростендиона и число антральных фолликулов (54). Более того, было показано, что у пациенток с СПКЯ измерение уровня АМГ может заменить ультразвуковой подсчет числа фолликулов. Это важно у тех пациенток, у которых сложно произвести ультразвуковое обследование яичников, например при ожирении (53). Стоит отметить, что увеличение продукции АМГ яичниками при СПКЯ вызвано не только увеличением числа фолликулов, вырабатывающих АМГ, но и увеличением выработки АМГ гранулезой этих фолликулов(52). Более того, увеличение в уровне АМГ наблюдается у пациенток с СПКЯ до наступления менархе, а также у дочерей пациенток с этим синдромом (13,61). Также измерение уровня АМГ у пациенток старшей возрастной группы, помогло разобраться с таким феноменом, как наступление поздней менопаузы у пациенток с СПКЯ. Действительно у таких женщин менопауза наступает позже на 1-2 года, чем в среднем по популяции и уровни АМГ выше, чем в контрольной группе здоровых женщин. Все это говорит о большой роли АМГ в патогенезе этого синдрома (55).
Причина, по которой при СПКЯ фолликулы остаются на стадии предшествующей селекции доминантного, остается неизвестной, и по этой причине трудно судить, является ли повышенный уровень АМГ продуктом остановки роста фолликулов или это повышение играет самостоятельную патогенетическую роль. В любом случае повышенный уровень АМГ блокирует ароматазу и препятствует дальнейшему росту продукции гранулезой эстрадиола (12).Исследования показали, что на клетках гранулезы фолликулов, полученных у пациенток с СПКЯ наблюдается повышенное число рецепторов к ФСГ и андрогенам, а также повышенная экспрессия уровня мРНК АМГ и соответственно повышенная продукция этого гормона. Более того, наблюдается феномен уменьшения продукции АМГ в ответ на добавление ФСГ и увеличение продукции этого гормона в ответ на добавление ЛГ. Уровень выделения АМГ клетками гранулезы, полученной от здоровых пациенток, не менялся в ответ на добавление в культуру ФСГ или ЛГ (9,52). Все это говорит о повреждении в секреции АМГ у пациенток с СПКЯ. Вероятно, высокий уровень АМГ в фолликулах пациенток с СПКЯ определяет резистентность к ФСГ. Дальнейшее подтверждение этого предположения нашло подтверждение в работе Бебия З.Н. с соавт., которые обнаружили, что при иммуногистохимической оценке содержания АМГ в гранулезных клетках больших антральных фолликулов полученных у пациенток с СПКЯ отмечается интенсивное окрашивание. В то же время у пациенток контрольной группы не наблюдалось окрашивания клеток гранулезы больших антральных фолликулов (2). Stubbs S. et al. исследовали ранние стадии роста фолликулов у пациенток с СПКЯ с помощью иммуногистохимического анализа. Было обнаружено парадоксально меньшее число АМГ-позитивных клеток гранулезы в примордиальных и первичных фолликулах у пациенток с СПКЯ, по сравнению с яичниками здоровых женщин. Авторы делают вывод о вовлеченности в процесс формирования СПКЯ самых ранних этапов роста фолликулов (65).
При анализе клеток гранулезы, полученной из фолликулярной жидкости, программе ЭКО, у пациенток с СПКЯ и у пациенток с трубно-перитонеальным фактором, выяснилось, что у пациенток с СПКЯ наблюдается более высокий уровень экспрессии АМГ и рецептора к ФСГ, как в фолликулах большого размера (17-22 мм в диаметре), так и малого (8-13 мм в диаметре). Также в гранулезе, полученной из фолликулов малого размера, у пациенток с СПКЯ наблюдалась повышенная экспрессия рецепторов к АМГ второго типа (AMH-RII) и к андрогенам, по сравнению с пациентками со здоровыми яичниками. Все это говорит о том, что высокий уровень АМГ может играть одну из ключевых ролей в патогенезе СПКЯ (9). Также имеется сообщение о повышенном содержании АМГ в фолликулярной жидкости и сыворотки крови у пациенток с этим синдромом по сравнению с пациентками со здоровыми яичниками, 7,01 ± 1,52 и 1,65 ± 0.23 нг/мл и 2.,7 ± 0,52 и 0,92 ± 0,19 нг/мл, соответственно (18). Высокий уровень АМГ в фолликулярной жидкости, и часто наблюдаемее плохое качество ооцитов у пациенток с СПКЯ, ставит вопрос о возможном действии АМГ как ингибитора мейоза в ооците (1,66). Однако дальнейшие исследования на животной модели показали, что АМГ не ингибирует процесс мейоза в ооцитах (69). Однако необходимые дальнейшие исследования этого механизма у человека (42).
Интересно отметить, что к фенотипу, характерному для СПКЯ могут приводить различные мутации в генах рецепторов к андрогенам, инсулину, к ЛГ и ФСГ (22,25,56,60). Недавно был обнаружен полиморфизм в гене к АМГ первого типа, который был ассоциирован с уровнем АМГ у пациенток с СПКЯ. Дальнейшие исследования должны показать, как эти изменения в рецепторе к АМГ могут влиять на резистентность к ФСГ, наблюдаемую у пациенток с СПКЯ (32).
Гипоталамическая аменорея и АМГ
Группа итальянских и израильских исследователей изучала уровни АМГ у пациенток с вторичной аменорей и у здоровых женщин. Пациентки с аменореей были отобраны по трем диагнозам: ПИЯ, функциональная гипоталамическая аменорея и СПКЯ. Было обнаружено, что у пациенток с ПИЯ уровень АМГ не определялся или был крайне низким, у пациенток с функциональной гипоталамической аменорей средний уровень АМГ составлял 3,9 + 1,5 нг/мл, у пациенток с СПКЯ 7,4 + 1,7 нг/мл и у здоровых женщин из контрольной группы 3,5 + 1,5 нг/мл. Эти данные показывают, что у пациенток с функциональной гипоталамической аменорей измерение АМГ дает представление о состоянии яичников, что может позволить произвести более точный дифференциальный диагноз при аменореи (35).
Роль АМГ в диагностике преждевременного истощения яичников (ПИЯ)
Преждевременное истощение яичников (ПИЯ) или по новой классификации, первичная яичниковая недостаточность (ПЯН), это гетерогенное состояние, которое характеризуется аменореей и менопаузальным уровнем ФСГ у женщин до 40 лет (49). В последние годы АМГ был предложен как показатель наличия фолликулов у пациенток с ПИЯ. Massin N. et al. измерили уровень АМГ, и сравнили его с данными биопсии яичников у 48 пациенток с ПИЯ и нормальным кариотипом. Выяснилось, что уровень АМГ был значительно выше у женщин, у которых при биопсии было обнаружено более 5 фолликулов. При иммуногистохимическом исследовании экспрессии АМГ клетками гранулезы фолликулов было обнаружено, что у пациенток с ПИЯ уровень выделения АМГ преантральными фолликулами находится в пределах нормы, однако в антральных фолликулах он снижен (43). Авторы делают вывод о важности измерения АМГ, как маркера наличия персистирующих фолликулов у пациенток с ПИЯ (44).
Также АМГ был предложен как перспективный показатель сохранности овариального резерва у пациенток, перенесших лечение онкозаболеваний в молодом возрасте. Bath L. et al. выяснили, что уровень АМГ значительно снижен, а базальный уровень ФСГ повышен у молодых пациенток перенесших лучевую и химиотерапию в детстве (6). Преимуществом измерения АМГ является то, что его можно измерять у пациенток с нерегулярным циклом во время приема КОК. Также уровень АМГ был измерен у молодых пациенток перенесших несколько циклов химиотерапии по поводу лимфагранулематоза. Выяснилось, что АМГ является лучшим показателем сохранности овариального резерва, чем базальные уровни ФСГ и ингибина В. Более того он является наиболее значимым маркером возникновения ПИЯ после лечения лимфогранулематоза (70).
АМГ и нервная анорексия
Нервная анорексия - это серьезное заболевание, которое заключается в частичном или полном отказе от пищи, что приводит к резкому уменьшению веса тела, нарушениям в эндокринной системе и к аменореи. Несмотря на то, что большой части пациенток удается с помощью психотропных препаратов и психологического воздействия вернуть к полноценному питанию, аменорея и нарушения менструального цикла могут наблюдаться в течение многих лет, после того как вес пришел в норму. Van Elburg A. et al. изучили значение измерения уровней АМГ, лептина, эстрадиола, ингибина В, ФСГ на вероятность восстановления функции яичников у пациенток с перенесенной нервной анорексией. Было обнаружено, что уровни АМГ, ингибина В и ФСГ независимо друг от друга могут определять вероятность восстановления функции яичников (72).
АМГ и эндометриоз
Недавно была опубликована работа, в которой были сравнены уровни АМГ у пациенток с малыми формами эндометриоза (первой и второй стадией по классификации американского общества репродуктивной медицины) и пациенток с трубным фактором бесплодия. Было обнаружено, что пациентки с эндометриозом имеют меньший уровень АМГ, 1,26 + 0,7 нг/мл по сравнению с 2,02 + 0,72 нг/мл у пациенток с трубным фактором, P=0,004. При анализе размеров фолликулов, которые могут продуцировать АМГ было обнаружено, что у пациенток с эндометриозом имеется большая, чем в контрольной группе гетерогенность в этой группе фолликулов и они в среднем имеют больший размер (41). Дальнейшие исследования должны показать не имеется ли дефект в секреции АМГ у пациенток с эндометриозом.
АМГ и гранулезо-клеточные опухоли
АМГ может быть маркером гранулезо-клеточных опухолей (ГКО) яичников. АМГ повышен от 76 до 93% пациенток с ГКО. Уровень этого гормона у этих пациенток в среднем составляет 190,3 нг/мл (от 2 до1124 нг/мл) (38). АМГ может служить маркером эффективности хирургического лечения и химиотерапии у пациенток с ГКО (37).
Влияние лекарственных препаратов на уровень АМГ
Somunkiran A. et al. изучили влияние комбинированных оральных контрацептивов (КОК) на уровень АМГ у пациенток с СПКЯ и здоровых женщин. Было определено, что после 6 месяцев применения КОК, уровень АМГ не менялся, тогда как объем яичников, общее число фолликулов, уровни ФСГ, ЛГ, эстрадиола и тестостерона уменьшались статистически достоверно (62) Динамика изменений гормональных и ультразвуковых показателей была идентична у пациенток с СПКЯ и здоровых женщин.
Назначение метформина (в среднем 1500 мг в день) в течение 6 месяцев пациенткам с СПКЯ приводило к статистически значимому снижению АМГ, с 12,2 + 2,1 нг/мл до 11,4 + 2,2 нг/мл, соответственно, P < 0,01). Также снижались объем яичников и число фолликулов (55).
Jayaprakasan K. et al. изучали влияние десенситизации гипофиза препаратами агониста люлиберина в программе ЭКО на такие показатели овариального резерва как уровень АМГ, ингибина В, ФСГ, ЛГ, эстрадиола и числа антральных фолликулов, подсчитанных с помощью трехмерного ультразвукового исследования. Указанные показатели были измерены на 2-3 дни менструального цикла и были сравнены с теми параметрами, что были получены после двух недель назначения агонистов люлиберина. Было показано, что уровень АМГ повысился на 32% (P < 0.01), тогда как уровни ингибина В, эстрадиола, ФСГ и ЛГ понизились на 40-50% (P < 0.01). Объем яичников уменьшился, тогда как число антральных фолликулов осталось неизменным. Авторы делают вывод, что десенситизация гипофиза позволяет получать большое число фолликулов способных отвечать на овариальную стимуляцию, показателем чего служит увеличение уровня АМГ(29).
Mohamed K. et al. исследовали влияние длительного воздействия агонистов люлиберина (4 и 8 недель применения депонированного агониста гозерелина) на уровень АМГ, ФСГ и ЛГ у пациенток с эндометриозом. Выяснилось, что уровни ФСГ и ЛГ снизились в среднем на 50% и 200-290 % (Р<0,01), соответственно, тогда как уровень АМГ не изменился. Авторы делают вывод, что длительное применение препаратов агонистов люлиберина не меняет числа антральных фолликулов (45).
После достижения десенситизации назначение препаратов мочевого или рекомбинантного ФСГ вызывает значительное снижение уровня АМГ. Было показано, что снижение уровня АМГ происходило постоянно во время стимуляции, и на день назначения овуляторной дозы ХГЧ составило 44% от дня начала стимуляции (1,21 + 0,11 и 0,53 + 0,06, соответственно, P < 0,001). Падение уровня АМГ происходило параллельно уменьшению числа антральных фолликулов менее 12 мм в диаметре и увеличению числа большего размера и концентраций в крови эстрадиола, ингибина В, прогестерона и тестостерона. Все это говорит о резком снижении во время овариальной стимуляции фолликулов которые способны вырабатывать АМГ в связи с их переходом в число быстрорастущих предовуляторных фолликулов (19).
Динамика уровня АМГ в лютеиновую фазу цикла в протоколе стимуляции ЭКО была изучена группой французских исследователей. Выяснилось, что по сравнению с днем назначения ХГЧ на четвертый день уровень АМГ падает в среднем на 64%, после чего повышается на 82% на восьмой день после назначения овуляторной дозы ХГЧ. Динамика падения и подъема АМГ совпадала по динамике с эстрадиолом, тогда как уровень прогестерона постепенно повышался с дня назначения ХГЧ до восьмого дня (21).
Падение уровня АМГ от дня назначения ХГЧ до четвертого дня можно объяснить процессами лютеинизации фолликулов с и резким снижением продукции этого гормона клетками желтых тел. Дальнейший подъем АМГ в середине лютеиновой фазы, вероятно, связан с процессом дальнейшего фолликулогенеза и формированием пула антральных фолликулов, из которого в следующем цикле будет выбираться доминантный (3,23).
Заключение
АМГ является одним из наиболее значимых регуляторов репродуктивной функции женщины, который отражает рост фолликулов от примордиального пула до стадии больших антральных. Появившаяся в последние годы возможность измерять уровень этого гормона в крови позволила по новому взглянуть на диагностику овариального резерва, СПКЯ, ПИЯ, гипоталамической аменореи, нервной анорексии, гранулезо - клеточных опухолей яичников. Кроме высокой точности в определении овариального резерва, АМГ может быть привлекательным, так как уровень этого гормона может быть измерен в любой день менструального цикла и при приеме КОК. Можно выразить уверенность, что изменение уровня АМГ войдет а ежедневную практику гинекологе - эндокринолога.http://myivf.spb.ru/stati/rolantimyullerovagormonaamgvnormeiprirazlichnihginekologicheskihzabolevaniyah.html
Опухлевидные процессы яичников.
http://radiomed.ru/forum/uzi-v-ghiniekologhii?page=1
К опухолевидным процессам яичников, согласно классификации ВОЗ [1], относятся:
- Лютеома беременности.
- Гиперплазия стромы яичника и гипертекоз.
- Массивный отек яичника.
- Единичная фолликулярная киста и киста желтого тела.
- Множественные фолликулярные кисты (поликистозные яичники).
- Множественные лютеинизированные фолликулярные кисты и/или желтые тела.
- Эндометриоз.
- Поверхностные эпителиальные кисты.
- Простые кисты.
- Воспалительные процессы.
- Параовариальные кисты.
Все женщины знают о наличии внутренних половых органов: матки и придатков. Однако мало кто реально может представить себе, как же на самом деле выглядят внутренние половые органы. Ниже представлены лапароскопические фотографии нормальной анатомии внутренних половых органов.

Рисунок 1. Нормальное строение внутренних половых органов при лапароскопии. Матка и придатки без особенностей, спаечного процесса в малом тазу нет.
К внутренним половым органам относятся яичники, маточные трубы, матка и влагалище.
К наружным половым органам относятся лобок, малые и большие половые губы и клитор. Все половые органы достигают полного развития с наступлением половой зрелости, когда устанавливается их циклическая деятельность, контролируемая гормональными и нервными механизмами.
На следующем рисунке Вам представлено схематическое изображение внутренних половых органов:

Рисунок 2. Схематическое изображение внутренних
половых органов.
Яичник выполняет 2 основные функции в организме женщины:
во-первых, генеративную, то есть в нем образуются половые клетки (яйцеклетки), которые участвуют в размножении и
эндокринную, то есть в нем вырабатываются половые гормоны, как мужские, так и женские.
Яичник состоит из фолликулов. Раз в месяц, в норме один из фолликулов под влиянием определенных гормонов начинает созревать, достигает к середине менструального цикла максимального размера (около 20 мм), и в среднем на 13-14 день при 28-дневном менструальном цикле так называемый доминантный фолликул разрывается с выбросом из него яйцеклетки, которая затем попадает в маточную трубу. Выход яйцеклетки из доминантного фолликула называется "овуляцией".
На месте разорвавшегося фолликула, стенки которого спадаются, образуется сгусток крови, который потом замещается соединительной тканью и "рассасывается".
Это образование в яичнике на месте разорвавшегося фолликула называется "желтое тело". Косвенно, по его наличию при ультразвуковом исследовании можно судить о наличии или отсутствии овуляции.
Механизмы овуляции:
Причины, по которым происходит отбор и развитие доминантного фолликула из огромного числа примордиальных фолликулов, еще не уточнены. В течение первой фазы цикла происходит 100-кратное увеличение объема фолликулярной жидкости, в которой также резко увеличивается содержание эстрадиола и ФСГ (фолликлостимулирующего гормона). Подъем уровня эстрадиола стимулирует выброс ЛГ (лютеотропного гормона).
Сам процесс овуляции представляет собой разрыв мембраны доминантного фолликула и кровотечение из разрушенных капилляров. Иногда этот процесс сопровождается дискомфортом внизу живота или болями (например, боли во время овуляции являются одним из характерных признаком эндометриоза). Изменения в стенке фолликула, обеспечивающие ее истончение или разрыв, определяются специальными ферментами (коллагеназа). После выброса яйцеклетки в полость фолликула начинают врастать формирующиеся капилляры, место начинает замещаться жировой тканью (т.е. клетки, которые были в фолликуле (гранулезные клетки) замещаются жировыми).
Полноценное желтое тело формируется только тогда, когда в доминантном фолликуле есть нужное количество гранулезных клеток с высоким содержанием рецепторов к ЛГ. Увеличение в размерах желтого тела после овуляции происходит в основном за счет увеличения размеров гранулезных клеток. Желтое тело у человека вырабатывает прогестерон, эстрадиол и андрогены, т.е. мужские половые гормоны.
Механизмы «рассасывания» желтого тела перед менструацией до настоящего времени неизвестны.
Менструальный цикл женщины условно подразделен на 2 фазы. Первым днем цикла считается первый день менструации.
1-я фаза длится от первого дня менструального цикла до овуляции, в среднем, ее продолжительность составляет 10-14 дней.
2-я фаза начинается после овуляции и длится до наступления менструации и является "царством" желтого тела. В этот период организм женщины готовится к возможной беременности.
Матка представляет собой полый орган с толстой мышечной стенкой, в которой происходит развитие плода.
Стенка тела матки состоит из 3 слоев:
1. Эндометрий - слизистая оболочка полости матки, которая подвергается изменениям в течение одного менструального цикла. Каждый цикл завершается удалением части эндометрия, что
сопровождается выделением крови (менструация);
2. Миометрий - самая толстая мышечная оболочка стенки матки;
3. Периметрий - серозная оболочка матки.
Маточная труба - трубчатый орган, который выполняет ряд функций:
1. Захватывает яйцеклетку, выделяющуюся из яичника при овуляции;
2. Осуществляет ее перенос в направлении матки;
3. Создает условия для транспорта спермиев в направлении от матки;
4. Обеспечивает среду, необходимую для оплодотворения и начального развития эмбриона;
5. Осуществляет транспорт эмбриона в матку;
6. В маточной трубе яйцеклетка может "встретиться" со сперматозоидом, и в этом случае происходит оплодотворение.
Ниже схематически представлен мехнизм нормального оплодотворения:

Рисунок 3. Оплодотворенная яйцеклетка в течение 4-5 дней продвигается по трубе в полость матки, где, затем прикрепляется в уже подготовленный утолщенный эндометрий (слизистая оболочка полости матки).
При нарушении проходимости маточных труб, при спаечном процессе в малом тазу или эндометриозе, оплодотворенная яйцеклетка может не закончить свой транспорт в полость матки и прикрепиться в различных отделах маточной трубы. В таком случае возникает патология, называемая внематочная беременность
Ненадолго остановлюсь на физиологической норме,чтобы уточнить некоторые терминологические моменты:
1)в норме,в каждом из яичников определяются несколько антральных фолликулов.Это мелкие,3-5 мм,фолликулы,некоторые из которых пройдут полный цикл созревания до преовуляторных фолликулов и овулируют. Остальные не будут увеличиваться,а подвергнутся обратному развитию;
2)день на десятый менструального цикла можно точно определиться,присутствуют ли в яичниках развивающиеся фолликулы. Развивающиеся фолликулы имеют диаметр от 10 мм. Развивающийся фолликул может быть один или их может быть несколько. Если их несколько,среди них выделяют доминирующий фолликул (самый крупный). Доминирующий фолликул дорастает до размеров преовуляторного,остальные фолликулы подвергаются обратному развитию;
3)на 13-й день цикла в одном из яичников определяется преовуляторный фолликул. Он имеет размеры 20-24 мм - размеры,при которых фолликул овулирует;
4)на 14-й день цикла (при наиболее типичном развитии событий) происходит овуляция - фолликул лопается,его покидает яйцеклетка.
Теперь немного о нарушениях,выявляемых в процессе мониторинга созревания фолликула:
1)если преовуляторный фолликул,диаметром 20-24 мм,на 14-й день менструального цикла не овулировал,далее возможны 4 варианта развития событий.
а)овуляция происходит,но позже (день на 17-й). Это является вариантом нормы. При этом фолликул несколько дней,после 14-го дня, сохраняется,а потом овулирует.
б)персистенция фолликула. фолликул сохраняется на протяжении всей второй половины (но не второй фазы) цикла; может сохраняться и после менструации. Размер персистирующего фолликула при этом не увеличивается и не уменьшается;
в)формирование фолликулярной кисты. При этом размер неовулировавшего фолликула прогрессивно увеличивается,достигает диаметра 30 мм и более (30-70 мм);
г)лютеинизация неовулировавшего фолликула. При этом происходит обратное развитие фолликула,прогрессивное уменьшение его в диаметре. Образующееяся в процессе лютеинизации жёлтое тело,вырабатывая прогестерон, создаёт гормональный фон второй фазы цикла.
Т.е. лютеинизация неовулировавшего фолликула возможна,это один из вариантов,но об этом можно говорить при наличии неовулировавшего преовуляторного фолликула (или доминирующего фолликула - если его инволюция начинается ещё до достижения им размеров преовуляторного).
Если же развивающихся фолликулов в яичниках нет,такой вариант нарушения следует называть отсутствием развивающихся фолликулов,а не лютеинизацией неовулировавшего фолликула.
И ещё немного о методах исследования. Измерение ректальной температуры является ценным методом,поскольку овуляция,как правило,сопровождается небольшим повышением ректальной температуры. Однако,ректальная температура позволяет судить о развитии фолликулов косвено,а УЗИ позволяет проследить этот процесс в деталях,поэтому приоритет в этой ситуации,безусловно,за УЗИ.
Удачи!
Девочки, всем привет!
Планируем малыша уже 4й цикл, спкя, но есть овуляция своя.
Немного предыстории.В этом цикле овуляция произошла загадочным образом, весь цикл был персистирующий фолликул в правом яичнике, на 35 ДЦ там же появился второй фолликул 16 мм(он вероятно и дал мне овуляцию)
9 декабря, понедельник 35 ДЦ где-т
Многоплодной называют беременность двумя или большим количеством плодов.
При наличии беременности двумя плодами говорят о двойне, тремя - о тройне и т.д. Каждый из плодов при многоплодной беременности называется близнецом.
Частота встречаемости. Многоплодная беременность составляет в среднем 1-2% от общего количества родов. Частота встречаемости при различном количестве плодов следующая:
• двойни - 1 на 87 родов;
• тройни (триплеты) - 1 на 6400 родов, или 1 на 87 двоен;
• четыре плода - 1 на 51 тыс. родов (873), или 1 на 87 троен. Однако истинная частота многоплодной беременности на сегодняшний день в развитых странах достигает 1:50, что в 2 раза больше, чем 20 лет назад - 1:101.
4.1. Дисфункция репродуктивной системы при гиперпролактинемии
Определение понятия. Гиперпролактинемия относится к числу наиболее распространенных эндокринных синдромов, развивающихся на стыке репродуктивной эндокринологии и клинической нейроэн-докринологии. Стремительное накопление знаний в этой области относится к 70-80-м гг. прошлого столетия, после выделения ПРЛ как самостоятельного гормона из гипофиза в 1970 г., что повлекло за собой цепь исследований, посвященных эндокринологии ПРЛ и клинической фармакотерапии гиперпролактинемических состояний с помощью бромкриптина [7, 61, 69].
ПРЛ относится к числу филогенетически наиболее древних гормонов, секретируемых передней долей гипофиза у позвоночных, причем к настоящему времени описано более 100 отдельных проявлений биологического его эффекта у различных видов животных (амфибии, рептилии, птицы, млекопитающие). Молекула ПРЛ состоит из остатков 198 аминокислот, последовательность включения которых в структуру молекулы в 16 % случаев идентична таковой гормона роста и также (16%) для плацентарного лактогена. Се-кретируемый гипофизом человека ПРЛ имеет различную молекулярную массу: -23 кДа (23К), -50 кДа (50К) и > 100 кДа (100К). Наиболее активную молекулярную форму представляет собой 23К ПРЛ, который у большинства людей составляет основную часть иммунореактивного гормона в крови. У женщин репродуктивного возраста стойкое повышение уровня ПРЛ в периферической крови, преимущественно за счет мономерной формы, приводит, как правило, к развитию синдрома персистирующей галактореи-аменореи, гипогонадизму бесплодию [11, 12]. Две другие иммунореактивные формы ПРЛ выявляются в крови обычно в небольших количествах. В ответ на введение антагониста рецепторов дофамина метоклопра-мида прирост содержания иммунореактивного гормона в сыворотке крови происходит в основном за счет низкомолекулярной формы и достигает максимума через 15-60 мин с последующим снижением к 60-120 мин уровня несколько превышающего исходный. Наряду с этим имеются данные о том, что однократное введение агониста ДА бромкриптина вызывает быстрое понижение уровня и общего, и низкомолекулярного иммунореактивного ПРЛ в крови при относительно слабом воздействии на уровень содержания высокомолекулярной его формы.
Молекулярный полиморфизм ПРЛ определяет значительное разнообразие биологических его эффектов при клинических проявлениях отдельных патологических состояний и симптомоком-плексов, а также нередкое несоответствие между повышенным уровнем ПРЛ в крови и клиникой заболевания. Так, например, при пролактинемии различного генеза, а также при нормопролактине-мической галакторее содержание высокомолекулярного ПРЛ в сыворотке крови почти в каждом 4-м наблюдении существенно превышает содержание низкомолекулярной его формы [12]. На основании изучения особенностей влияния фармакологической стимуляции секреции ПРЛ на уровень содержания высоко- и низкомолекулярных его форм (при гиперпролактинемии с преобладанием ПРЛ с высокомолекулярной массой) было высказано предположение относительно различной биохимической природы этих двух форм и о негипофизарном происхождении высокомолекулярной формы или ее основной части. Не исключено, что этот феномен является следствием связывания мелких молекул ПРЛ с белками плазмы или их агрегации в сыворотке крови после освобождения их гипофизом. Возможно также, что одной из причин идиопатической гиперпролактинемии может быть присутствие в циркулирующей крови антипролактиновых аутоантител и связывания именно с ними значительного количества мономера ПРЛ. Результаты этих исследований послужили основанием для рекомендаций относительно целесообразности включения в алгоритм обследования пациенток со сложными в дифференциально-диагностическом отношении формами заболевания определения не только общего ПРЛ, но и высоко- и низкомолекулярных его форм в отдельности [11, 13].
В отличие от других гипофизарных гормонов ПРЛ не специализирован на регуляции какой-либо одной или даже нескольких функций организма, но вовлечен во многие физиологические процессы, в том числе в морфогенез, специфические клеточные функции, а также в репродуктивное поведение в целом и гестационный процесс в частности. Многие биологические эффекты ПРЛ - от участия в обмене электролитов до поведенческих реакций - в той или иной степени сопряжены с секрецией стероидных гормонов. Выявлены временные связи между уровнями ПРЛ и гонадотропных и стероидных гормонов в периферической крови. К числу наиболее выраженных биологических эффектов ПРЛ относится влияние на молочные железы и выделительную функцию почек. Гиперпролак-тинемия может быть обусловлена функциональной гиперсекрецией (так называемая функциональная гиперпролактинемия) или наличием микро- или макропролактином гипофиза. Сочетающиеся с гипер-пролактинемией нарушения состояния репродуктивной системы у женщин клинически проявляются нарушением овуляции и функции желтого тела, олиго- и/или аменореей, бесплодием, галактореей.
Частота. К сожалению, до настоящего времени мы не располагаем надежной информацией о частоте гиперпролактинемических состояний в женской популяции, а представляемые в отдельных литературных источниках сведения касаются обычно определенных когорт пациенток, обращающихся за помощью по поводу бесплодия, аменореи, галактореи и других патологических состояний репродуктивной системы.
В соответствии со сводными данными 12 публикаций, представленными на основе обобщения материалов 2293 наблюдений, частота выявления гиперпролактинемии у страдающих аменореей женщин достигает в среднем 25,2 % с колебаниями в отдельных исследованиях в пределах от 11 до 47 %. Вместе с тем было отмечено, что галакторея имела место лишь у 55,6 % женщин с выявленной в ходе исследования гиперпролактинемией (колебания от 35 до 89 %). Аналогичные данные о частоте гиперпролактинемии получены в одном из исследований при обследования 324 пациенток, обратившихся по поводу вторичной аменореи. Гиперпролактинемия была
выявлена в 26,3 % случаев, причем в каждом 4-м наблюдении в сочетании с аденомой гипофиза. При скрининговом обследовании 1400 пациенток, обратившихся в клинику бесплодия нашего Центра, различная степень гиперпролактинемии была диагностирована в 18,9% [61].
Косвенное представление о частоте гиперпролактинемии могут дать сведения об этиологической структуре отдельных форм этой патологии, в том числе и у больных, оперированных по поводу про-лактином. Так, по данным анамнеза 120 пациенток, наблюдавшихся в связи с операциями по поводу микро- и макропролактином, опухоль гипофиза была выявлена на фоне первичной аменореи в 8 % случаев, после стресса - в 2,5 %, после родов - в 10 %, на фоне олигоменореи - в 35 %, после перорального приема контрацептивов - в 60%. В анамнезе других 45 пациенток, подвергшихся операции по поводу микропролактином, стресс было отмечен в 4 % случаев, предшествующие выявлению заболевания роды - в 11%, пероральный прием контрацептивов- в 22%, олигомено-рея - в 50%. Кроме того, 2/3 из них длительное время принимали с лечебной целью эстрогенные и гестагенные препараты. В других литературных источниках можно также встретить указания на то, что при гиперпролактинемии опухоли гипофиза обнаруживаются в 32 % случаев, частота использования оральных контрацептивов достигает 63,5 %, нарушения менструального цикла - 85 % (в том числе олигоменорея - 27 %, аменорея - 58 %, галакторея -67 %, гирсутизм - 42%), снижение либидо отмечают 60,5% пациенток.
Хотя приведенные сведения и не дают полного представления об истинной частоте гиперпролактинемии в женской популяции, тем не менее они позволяют ориентироваться в том, среди каких контингентов гинекологических больных определение концентрации ПРЛ в плазме периферической крови необходимо и целесообразно уже на начальных этапах обследования по поводу нарушений репродуктивной функции. К настоящему времени совершенно очевидна (и это подтверждает наш личный опыт!) необходимость соответствующего обследования пациенток не только с типичными для синдрома гиперпролактинемии нарушениями, но также и больных с болезнью поликистозных яичников, предменструальным синдромом, так же как и женщин старших возрастных групп при тяжелом и резистентным по отношению к традиционному лечению течении КС.
Этиология и патогенез. Гиперпролактинемия может быть обусловлена физиологическими причинами, фармакологическими воздействиями и рядом патологических состояний нейроэндокринной системы. У практически здоровых женщин повышение содержания ПРЛ в плазме периферической крови наблюдается во время сна (что связано с циркадианным биологическим ритмом), после физических упражнений и при стрессовых ситуациях. Уровень ПРЛ возрастает в поздней фолликулиновой фазе менструального цикла, на протяжении беременности, в процессе кормления грудью после родов, во время полового акта. Физиологическая гиперпролактинемия характерна также для плода и новорожденного в перинатальном периоде.
Гиперпролактинемию могут вызывать следующие причины:
пролиферация лактотрофов в передней доле гипофиза (про-лактинома);
другие опухоли гипофиза, которые блокируют тормозящие влияния гипоталамуса, а именно секрецию ПИФ, а также клинически нефункционирующие аденомы гипофиза или опухоли параселлярной локализации (менингиома, кранио-фарингиома);
эндокринные заболевания: первичный гипотиреоз (как следствие пролактинстимулирующего действия тиролиберина), болезнь поликистозных яичников, синдром Иценко-Ку-шинга, а также заболевания легких и почек;
ятрогенные воздействия лекарственных препаратов: нейролептики (фенотиазин, бутирофенон), транквилизаторы (бензодиазепин), антигипертензивные средства (резерпин, метилдофа), эстрогены (высокие дозы), оральные контрацептивы (ОК), а также неблагоприятные экологические условия [131, 150, 204].
В патогенезе нарушений менструальной и репродуктивной функций при стабильной гиперпролактинемии существенную роль играет изменение импульсного ритма секреции ГЛ и гонадотропных гормонов, а степень нарушений ритма и амплитуды секреции ЛГ и ФСГ находится в обратной зависимости от уровня содержания ПРЛ в сыворотке периферической крови [76]. Характеристика импульсной секреции ЛГ и ФСГ у здоровых женщин и пациенток с гипер-пролактинемией представлена в табл. 4.1 [76]. Базальный уровень гонадотропных гормонов в крови у большинства пациенток с гипер
пролактинемией и бесплодием не отличается от нормы и только у 18 % обследованных с макропролактиномами больших размеров он снижен [62]. Функциональная активность гонадотрофов (по данным пробы с ГЛ) оказалась сохраненной у всех обследованных пациенток с функциональной гиперпролактинемией и микропролактиномами, уровень ЛГ возрастал в сравнении с исходным на 630 %, ФСГ - на 310%; у пациенток с макропролактиномами - на 321и215% соответственно. Своеобразная гиперергическая реакция отмечена у больных с поликистозными яичниками и гиперпролактинемией. Установлено также, что рецепция эстрогенов на уровне гипотала-мо-гипофизарных центров (по данным комбинированной пробы с эстрогенами и ГЛ) находится в пределах нормы вне зависимости от степени гиперпролактинемии. Описаны случаи гиперпролактинемии, сочетающейся с кальцификацией ножки гипофиза.
Гипоталамическая локализация нарушений репродуктивной функции при гиперпролактиновой аменорее находит подтверждение в ряде публикаций, свидетельствующих о существенном повышении уровня содержания в-эндорфина в периферическом кровотоке данного контингента больных и его нормализации в случае восстановления овуляции в процессе лечения агонистом ДА парло-делом. При отсутствии эффекта от лечения уровень Р-эндорфина в крови существенно не меняется. Эти данные указывают на роль нарушений опиоидного контроля репродуктивной системы в патогенезе гиперпролактинемической недостаточности яичников.
Пато- и морфогенез пролактином гипофиза, несмотря на многочисленные исследования, остается предметом длительных дискуссий. В частности, обращает на себя внимание возникновение указанных опухолей у женщин преимущественно репродуктивного возраста, причем нередко после гормональной контрацепции или после родов. Многие исследователи отмечают, что применение эстрогенов способствует повышению синтеза и секреции ПРЛ на уровне гипофиза. Экспериментальные данные свидетельствуют о том, что рецепторы дофамина, расположенные на мембране лактотрофов, подвержены регулирующему влиянию стероидных гормонов. При высокой концентрации Э2 и низком содержании прогестерона в периферической крови количество рецепторов снижается; добавление же прогестерона способствует восстановлению нормального количества дофаминсвязывающих мест. Остается дискуссионным вопрос о том, являются ли аденомы гипофиза следствием гипер-или гипопродукции гипоталамических факторов или же возникают в результате возможных биохимических дефектов непосредственно в лактотрофах. Высказывается мнение, что именно последние могут служить причиной образования пролактином.
Выделение микро- и макропролактином имеет важное значение для практики, так как каждая из них характеризуется соответствующими клиническими проявлениями. Большинство пролактином имеет ультраструктуру, типичную для клеток, активно синтезирующих белковые гормоны. В ткани опухоли по мере ее роста нередко обнаруживаются вторичные изменения - кровоизлияния, кальци-фикация, амилоидное перерождение. В окружающей сосуды опухоли ткани обнаруживается фиброз. Под влиянием бромкриптина наблюдаются изменения как общей структуры, так и ультраструктуры пролактином. Через неделю после начала приема препарата размеры лактотрофов уменьшаются почти на 1/4 (23 %) от исходного. При лечении на протяжении 3 мес. и более усиливается фиброзирова-ние опухоли, однако после его прекращения происходит довольно быстрое восстановление первоначальной конфигурации и структуры опухоли. Результаты клинических наблюдений дают основание считать, что, несмотря на отсутствие ультраструктурных различий, микро- и макропролактиномы являются разными в морфогенети-ческом отношении типами опухолей. В отличие от макропролактином, микропролактиномы обычно не проявляют выраженной тенденции к росту.
Детальное изучение синдрома гиперпролактинемии позволило выделить две основные клинико-патогенетические формы заболевания - функциональную (идиопатическую) гиперпролактинемию и гиперпролактинемию, обусловленную наличием микро- или ма-кропролактиномы. Кроме того, при синдроме гиперпролактинемии выделяют заболевания, развивающиеся на фоне кистозных опухолей гипофиза и «пустого» турецкого седла.
Особое место в проблеме гиперпролактинемии у женщин занимает вопрос о связи этого синдрома с первичным гипертиреозом [63]. Имеются данные, что основными факторами, провоцирующими развитие гиперпролактинемии у больных первичным гипотиреозом женщин, могут служить беременность, роды и аборты. У больных с первичным гипотиреозом и нормопролактинемией имеет место корреляционная связь между уровнем тироксина и концентрацией ПРЛ, тогда как при гиперпролактинемии подобная связь отсутствует [69].
Значительные сложности в теоретическом и практическом отношении вызывает та форма гиперпролактинемии, которую выделяют как функциональную, или идиопатическую. В литературе активно обсуждается вопрос о том, является ли она промежуточной стадией в развитии пролактиномы или самостоятельной формой заболевания. Приводятся данные обследования 75 женщин с регулярным менструальным циклом и 44 пациенток с гиперпролактинеми-ей (концентрация ПРЛ в плазме крови 20-130 нг/мл), позволившие сделать заключение, что больные с диагнозом «идиопатическая гиперпролактинемии» представляют собой неоднородный контингент. Среди них были выделены пациентки с повышенным уровнем ПРЛ в плазме крови на фоне измененных ответов на соответствующие функциональные пробы и пациентки с недиагностированными ранее микро- и макропролактиномами. К аналогичному заключению пришли и другие исследователи [62].
Клиника. Клиническая характеристика синдрома гиперпролактинемии довольно разнообразна. Наиболее полное представление об отдельных клинико-патогенетических его формах дает анализ анамнестических и клинических данных, полученных при обследовании гетерогенного контингента пациенток, обращавшихся за помощью в клинику женского бесплодия. Частота выявления гиперпролактинемии у этого контингента женщин настолько велика, что нельзя не согласиться с предлагаемым ВОЗ алгоритмом, согласно которому определение уровня ПРЛ должно служить первым этапом обследования супружеской пары при бесплодном браке [70].
Согласно приводимым по материалам НЦ АГиП РАМН данным обследования пациенток с гиперпролактинемией, наследственная предрасположенность к нарушениям менструального цикла, ней-роэндокринным заболеваниям и бесплодию имеет место у каждой 5-й пациентки, тяжелые стрессовые воздействия в детском и пубертатном возрасте - у 8,1 % больных. В большинстве наблюдений возраст менархе и ритм менструаций соответствовали региональным нормам. Вместе с тем к моменту обследования нарушения менструального цикла по типу аменореи имели место в 74,4 % наблюдений, олигоменореи - в 20,4%; менструации были регулярными у 5,2% больных. В 75 % наблюдений бесплодие было первичным. Нарушения менструальной и репродуктивной функций при первичном бесплодии чаще всего выявлялись с началом половой жизни (42,5 %) и после тяжелых стрессовых ситуаций (13 %), а при вторичном - после родов (41,3 %) и самопроизвольного выкидыша (31,7 %). Внезапное, без очевидных причин прекращение менструаций было отмечено в 28,6 % наблюдений, что оказалось довольно характерным для контингента пациенток с быстрорастущими макропролактиномами гипофиза [62].
При гиперпролактинемии нередко наблюдается избыточная масса тела, в связи с чем определение уровня ПРЛ рекомендуется также у пациенток с эндокринным ожирением и в случае острой прибавки массы тела. Наблюдения над когортой мужчин с макроаденомами показали, вместе с тем, что прибавка и/или избыточная масса тела с размером опухоли непосредственно не связана. Наряду с этим отмечено, что лечение, способствующее нормализации уровня ПРЛ, приводит к снижению массы тела в 90 % наблюдений. Избыток массы тела при гиперпролактинемии нередко сочетается с задержкой жидкости в организме, что в определенной степени обусловливает характерный внешний вид данного контингента женщин. Изменения водного обмена сопряжены с изменениями в системе регуляции вазопрессин-окситоцин-кортизол. Так, по данным литературы, у здоровых женщин после водной нагрузки наблюдается снижение уровня содержания в плазме крови аргинина-8-вазопрессина, ок-ситоцина и кортизола и одновременно обнаруживается тенденция к снижению уровня ПРЛ, тогда как при гиперпролактинемии происходит задержка жидкости на фоне парадоксального повышения содержания аргинина-8 и окситоцина при неизмененном уровне кортизола и отсутствии изменений уровня ПРЛ.
По мере угасания функции репродуктивной системы уровень секреции ПРЛ в организме женщины имеет тенденцию к снижению, и в постменопаузальном периоде уровень секреции ПРЛ оказывается сниженным. При постменопаузальном синдроме гипер-пролактинемия относится к числу довольно редких состояний и при обследовании 2322 женщин в этом периоде жизни была выявлена лишь в 1 % наблюдений. Вместе с тем на фоне ЗГТ было отмечено существенное возрастание уровня ПРЛ [174]. Гиперпролактинемия способствует снижению минеральной плотности костной ткани (МПКТ) в организме женщины и в репродуктивном возрасте, что в первую очередь связывают с гипоэстрогенией. При этом, однако, не исключается возможность и прямого воздействия ПРЛ. Гиперпролактинемия выявляется также и при тяжелых аутоиммунных состояниях, таких как системная красная волчанка, артрит, увеит и др., в связи с чем к числу биологических эффектов ПРЛ относят и иммуномодулирующее воздействие.
К выраженным клиническим проявлениям гиперпролактинемии относятся и психоэмоциональные нарушения. Колебания уровня ПРЛ оказывают влияние на настроение, эмоции и поведение. В литературе можно встретить указания о том, что такие психологические факторы, как стресс и др., могут стимулировать повышение секреции ПРЛ и играть определенную роль в развитии пролактинсекретирую-щей опухоли гипофиза. Основной механизм физиологического воздействия ПРЛ направлен на метаболическую и поведенческую адаптацию к беременности и заботу о потомстве. Прицельное изучение психобиологических соотношений при различных формах первичной гиперпролактинемии было проведено у 53 женщин 18-64 лет, страдающих персистирующей галактореей и опсоменореей. При двукратном выявлении уровня ПРЛ > 670 мМЕ/мл была использована методология параллельного обследования двумя независимыми психиатрами с последующей оценкой надежности процедуры. У находившихся под наблюдением женщин психические нарушения, среди которых преобладали аффективные и соматоформные расстройства, были выявлены в 70 % случаев. При исследовании же личностных особенностей было обнаружено характерное сочетание усиленных симбиотических тенденций с консерватизмом, самодостаточностью и стеничностью [7]. В литературе можно встретить также указания на то, что у больных с пролактиномами психоэмоциональные нарушения сохраняются иногда и после успешно проведенного лечения и восстановления нормального гормонального профиля. Между тем у части женщин нормализация уровня ПРЛ и восстановление овуляции под влиянием парлодела сопровождаются исчезновением психосексуальных расстройств.
Что же касается тяжести нарушений менструального цикла, то отмечена прямая коррелятивная зависимость между тяжестью нарушений менструального цикла и степенью выраженности гиперпро-лактинемии при бесплодии [62]. Уровень ПРЛ существенно выше при олигоменорее - 2440 (2080-2965) мМЕ/л (р < 0,05) и, особенно, аменорее - 6989 (4960-10048) мМЕ/л (р < 0,01) по сравнению со значением при сохраненном ритме менструаций - 925 (730-965) мМЕ/л. Напротив, между уровнем ПРЛ и содержанием гонадотропинов и Э2 установлена существенная коррелятивная зависимость. В соответствии с указанными особенностями гормональных соотношений хроническая ановуляция отмечена у всех больных с аменореей и у 71 % с олигоменореей, а недостаточность лютеиновой фазы цикла - у 29 % больных с олигоменореей и у всех больных с регулярным ритмом менструации.
Значительный интерес вызывают особенности развития га-лактореи у данного контингента больных. Выше были приведены данные, свидетельствующие о том, что хотя галакторея и патог-номонична для гиперпролактинемии, но отнюдь не является об-лигатным ее признаком. При гиперпролактинемии и бесплодии она была диагностирована у 77,4% больных, причем у 3,3% она носила транзиторный характер. В 55,6 % наблюдений появление галактореи совпало хронологически с нарушениями менструального цикла, а в каждом 5-м наблюдении выявление галактореи на 1,2 ± 0,8 года предшествовало их появлению. У 64 % пациенток обусловленная приемом эстроген-гестагенных препаратов галакторея возникала одновременно с нарушениями менструального цикла. Среди данного контингента больных галакторея диагностирована у 75,6% пациенток с аменореей, у 50,9% - с олигоменореей и у 28,5 % - с регулярным ритмом менструаций. Рентгенологическими методами патология молочных желез обнаружена у значительного большинства больных, из числа которых у 52,3 % были выявлены гиперпластические процессы, что в 2 раза превышает средние по-пуляционные данные. Не соответствующие возрасту инволютивные изменения отмечены в 26,2 % наблюдений, гирсутизм различной степени - в 38,3 %; уровень кортизола колебался в пределах нормы; СПКЯ был диагностирован у 11,8 % пациенток. При выявлении гиперандрогении сочетанный генез последней выявлен в 58,3 % случаев, яичниковый - в 29,2 %, надпочечниковый - в 12,5 %.
Таким образом, современный этап развития учения о нарушениях репродуктивной системы при гиперпролактинемии пополнился новыми и важными для повседневной клинической практики данными относительно функциональной гиперпролактинемии и связи между повышением уровня ПРЛ в периферической крови с некоторыми патологическими состояниями женской половой системы. Использование возможностей эндоскопических технологий для верификации этих состояний при бесплодии позволило дифференцировать их частоту у женщин с регулярным циклом и олигоменореей. При регулярном менструальном цикле и гиперпролактинемии наружный генитальный эндометриоз был выявлен в 55,4 % наблюдений, хроническое воспаление органов малого таза - в 27,2 %, миома матки - в 12,1 %, киста яичников - у 4,8 % женщин. При олигоменорее структура гинекологических заболеваний оказалась иной. Так, у 66,6 % женщин этой группы были выявлены поликистозные яичники, у 11,9% - наружный генитальный эндометриоз, у 9,6% - хроническое воспаление органов малого таза, у 4,8 % - миома матки. Изменения со стороны гениталий отсутствовали в 7,1 % наблюдений [60]. Наряду с выявленными закономерностями значимость результатов этих исследований заключается также и в том, что они проливают свет на природу и степень вовлеченности центральных структур регуляции репродуктивной системы женщины в патофизиологию системных изменений при распространенных гинекологических заболеваниях.
Диагноз. Важную роль в установлении диагноза играет тщательное изучение общего и специального анамнеза с обращением особого внимания на воздействие разнообразных стрессорных факторов. Накопленный в последние два десятилетия опыт позволяет утверждать, что выявление повышенного уровня ПРЛ в плазме периферической крови является одним из важнейших показателей нарушения процессов гипоталамической регуляции. Поскольку в развитии гиперпролактинемии ведущую роль играет широкий спектр системных изменений преимущественно центрального ге-неза, очевидна необходимость детального общетерапевтического обследования пациенток с уделением большого внимания состоянию эндокринной системы, особенно функции щитовидной железы и коры надпочечников. Выявление у данного контингента больных первичного гипотиреоза или другой эндокринной патологии может оказать существенное влияние на составление индивидуальной программы лечебных мероприятий.
Определение уровня ПРЛ в плазме периферической крови обычно сочетают с традиционной оценкой состояния репродуктивной системы путем определения соотношений между гонадотропными и половыми стероидными гормонами. В связи с тем, что наряду с бесплодием к числу наиболее характерных клинических проявлений нарушений репродуктивной системы при гиперпролактинемии относятся нарушения менструальной функции по типу олиго- или аменореи, одной из первоочередных задач является проведение дифференциального диагноза между основными клиническими вариантами этих нарушений.
В соответствии с общепринятыми представлениями, первичная аменорея - это отсутствие менархе у девочек-подростков в возрасте 16 лет, вторичная аменорея - отсутствие менструаций на протяжении 6 мес. у нормально менструировавших до развития заболевания женщин. Поскольку представление об аменорее относится к числу симптомов, а не диагнозов, трактовка результатов гормональных исследований требует четкой ориентации врача в патогенетических характеристиках основных форм аменореи у женщин репродуктивного возраста - гиперпролактиновой, гипо- и гипергонадотропной и нормогонадотропной, обусловленной нарушениями цирхорально-го ритма выделения ГЛ.
Параллельно с определением гонадотропных гормонов и ПРЛ исследуют концентрацию тиреоидных гормонов и содержание кор-тизола. При определении степени пролактинемии следует учитывать особенности физиологических колебаний уровня содержания ПРЛ в плазме периферической крови. Подобный подход имеет особое значение для диагностики функциональной гиперпролактинемии, которую можно выявить в части наблюдений лишь при исследовании проб крови в период физиологического подъема уровня ПРЛ во время сна (от 3 до 6 часов утра). Важное значение имеет и кратность исследований, которая позволяет отличить транзиторную гиперпролактинемию от перманентной. В связи с этим рекомендации о количестве необходимых гормональных исследований уровня ПРЛ для выявления гиперпролактинемии неоднозначны. Так, в
повседневной клинической практике для первоначального выявления умеренной гиперпролактинемии чаще прибегают к 3-кратному определению ПРЛ. Между тем в целях дифференциального диагноза между стабильной и транзиторной (функциональной) ги-перпролактинемией некоторые авторы предлагают даже 5-кратное исследование концентрации ПРЛ. Определение же циркадианного профиля содержания ПРЛ имеет особую диагностическую и прогностическую ценность при обследовании больных с пролактино-мами и выявлении при рентгенологическом исследовании «пустого» турецкого седла. У пациенток с гиперпролактинемией существенно снижены и величина ночного подъема ГГРЛ, и суточная амплитуда его колебаний.
На рис. 4.1 представлены данные об уровне пролактинемии при галакторее различной этиологии [143]. Имеются также данные относительно суточных флюктуации ПРЛ в крови при различных формах гиперпролактинемии. Так, при первичном гипотиреозе, со
Рис. 4.1. Содержание ПРЛ в плазме периферической крови при галакторее различной этиологии (по [143]):
А - опухоли гипофиза; В - идиопатическая форма с сохраненным менструальным циклом; С- идиопатическая форма с аменореей; D - послеродовая аменорея-галакторея (синдром Киари-Фроммеля); Е- применение транквилизаторов; F- после пероральной контрацепции; G- гипотиреоз; Н- «пустое» турецкое седло; J - разное. Темные кружки - пациентки с акромегалией; светлые кружки или треугольники - пациентки, обследованные только после операции или радиотерапии провождающемся лактореей-аменореей, гиперпролактинемия имеет постоянный характер без суточных колебаний; при первичном гипотиреозе с лактореей и нарушениями менструального цикла или без таковых отмечается транзиторная ночная гиперпролактинемия, тогда как у женщин с первичным гипотиреозом без нарушений со стороны репродуктивной системы обычно сохранен физиологический ритм секреции ПРЛ с параметрами, соответствующими здоровым женщинам. При первичном гипотиреозе развитие гиперпро-лактинемии не связано ни с возрастом, ни со степенью тяжести заболевания [143].
Несмотря на значительное количество фармакологических проб, применяемых при диагностике синдрома гиперпролактинемии, ни один из динамических тестов не дает возможности безошибочно дифференцировать гиперпролактинемию, обусловленную развитием опухоли гипофиза, от других форм неопухолевой природы. Вместе с тем сопоставление исходного уровня ПРЛ со степенью реакции на функциональные нагрузки имеет важное вспомогательное значение. Вероятность наличия пролактинсекретирующей опухоли гипофиза тем выше, чем выше базальный уровень ПРЛ и чем ниже реакция на фармакологические пробы.
Для проведения стимулирующих фармакологических проб используются антагонисты дофамина, воздействующие на синтез и освобождение ПРЛ (галоперидол, хлорпромазин, метоклопрамид). Ингибирующие пробы основаны на применении агонистов ДА, взаимодействующих с его рецепторами. Наиболее широко используют такие агонисты ДА, как L-дофа, апоморфин, бромкриптин, метерголин, амфетамин. При проведении функциональных проб с последующим динамическим определением уровня ПРЛ и ТТГ в сыворотке крови наибольшее распространение получили следующие дозы: тиролиберин - 400 мкг в/в, бромкриптин - 5 мг внутрь, соматостатин - 50 мкг/кг/мин в/в, ГЛ - 100 мг в/в.
Некоторые затруднения в диагностическом отношении вызывают выявление и трактовка спорадической гиперпролактинемии, определяемой у части как практически здоровых, так и страдающих бесплодием женщин в середине фазы роста и созревания фолликула и/или лютеиновой фазы цикла. С нашей точки зрения, обнаружение этого феномена проливает свет на некоторые интимные механизмы связи между уровнем секреции ПРЛ, функцией яичников и тиреоидной системой.
Так, при изучении феномена спорадической гиперпролактинемии в целях выявления однократного или повторного повышения уровня ПРЛ в крови у 133 волонтеров с верифицированной овуляцией и нормопролактинемией было сделано заключение о том, что спорадическая гиперпролактинемия в лютеиновой фазе цикла относится к числу относительно распространенных и обычных явлений. Она была отмечена у 36 % обследованных, причем в большинстве наблюдений (69 %) наблюдалось повторное повышение уровня ПРЛ [204]. В другом исследовании [158] тест с метаклопрамидом был использован в целях выявления латентной гиперпролактинемии (повышение уровня ПРЛ до 150 нг/мл и более) в середине фазы роста и созревания фолликула методом случайной выборки у 174 женщин с бесплодием. В ходе этих исследований были определены группы риска выявления латентной гиперпролактинемии в середине фол-ликулиновой фазы цикла. К данной категории женщин авторами отнесены пациентки, у которых до функциональной нагрузки имел место более низкий уровень ЛГ (р < 0,01) и Э2 (р < 0,001) и более высокий уровень тестостерона (р < 0,005) в сравнении с теми, у кого латентная гиперпролактинемия не была выявлена [12].
Как уже указывалось, к числу возможных ятрогенных причин гиперпролактинемии относится применение ОК. В связи с этим для определения риска развития данной патологии отдельные авторы считают целесообразным определение уровня ПРЛ в крови у женщин до начала гормональной контрацепции. Подобное заключение основывалось на данных наблюдения за 100 женщинами 19-35 лет, которые пользовались оральной контрацепцией на протяжении 6- 120 мес. и были рандомизированы соответственно дозе эстрогена в препарате (35 и 50 мкг). Было отмечено существенное возрастание уровня содержания ПРЛ в сыворотке крови на фоне приема контрацептивных препаратов в обеих группах обследованных, причем более значительное при приеме высокодозированных соединений. Вместе с тем, по данным наблюдения за 16 молодыми женщинами с идиопатической гиперпролактинемией и 8 с микроаденомой гипофиза, не было отмечено неблагоприятного влияния после 2-летнего приема ОК современных поколений на размер опухоли при несущественных колебаниях уровня ПРЛ [204]. Приведенные выше данные дают основание рекомендовать включение определения ПРЛ в спектр исследований, необходимых для индивидуального подбора метода регуляции репродуктивной функции.
Рентгенологическое исследование черепа проводится, как правило, на начальных этапах обследования больных с нейроэндокрин-ными нарушениями репродуктивной системы. При гиперпролакти-немии оно проводится в двух проекциях: исследуют форму, размер и контуры турецкого седла - костного ложа гипофиза - при фокусном расстоянии 60 см. При прицельном снимке турецкого седла измеряют сагиттальный, т.е. наибольший переднезадний размер седла (составляющий в среднем около 12 мм) и вертикальный размер или высоту седла (около 9 мм). Результаты компьютерной томографии в качестве второго этапа обследования дают возможность дифференцировать органические изменения гипофиза - макропролактино-мы, кистозные опухоли, «пустое» турецкое седло. К ранним рентгенологическим признакам опухоли гипофиза относятся: локальный остеопороз стенок турецкого седла, тотальный остеопороз стенок седла без изменений структуры костного свода черепа, неровность участка внутреннего контура костной стенки седла и частичное или тотальное истончение передних и задних клиновидных отростков. Диагностическое значение имеет также и симптом двойных контуров. В литературе имеются указания на наличие прямой коррелятивной зависимости между исходным базальным уровнем ПРЛ и размером турецкого седла на краниограмме. Исключение составляет группа пациенток с турецким седлом, у которых увеличение размера последнего или выявление 2-3-контурного дна сочетается с умеренной гиперпролактинемией.
У женщин с гиперпролактинемией и бесплодием характерные для макропролактиномы краниографические признаки выявляются в каждом 5-м наблюдении [62]. Результаты использования компьютерной томографии и ядерного магнитного резонанса, используемых в качестве второго этапа обследования, дают возможность верифицировать диагноз пролактиномы величиною до 1 см. Схематическое изображение рентгенологических признаков опухолевого процесса в гипофизе представлено на рис. 4.2. Подобные исследования сочетают также с традиционными исследованиями состояния ЦНС (реография сосудов мозга, ЭЭГ, офтальмоскопическое исследование и т.д.).
Поскольку гиперпролактинемия постоянно сопровождается бесплодием, перечисленный выше спектр специальных исследований сочетают обычно с детальным обследованием состояния репродуктивной системы бесплодной пары. Алгоритм обследования
бесплодной пары, предлагаемый ВОЗ, представлен схематически на рис. 4.3 [70,71].
Клинико-диагностические критерии отдельных форм гипер-пролактинемии, полученные на основе комплексного динамического обследования соответствующего контингента гинекологических больных, представлены ниже [62].
Функциональная гиперпролактинемия характеризуется отсутствием изменений в области турецкого седла на краниограмме и томограмме при повышении уровня ПРЛ до 2000 мМЕ/л и положительных пробах с метоклопрамидом и тиролиберином. Менструальный цикл регулярный (в 32 % случаев) или нарушен по типу олигоменореи (в 64% случаев). Галакторея диагностируется у 30% больных. Гиперпластические процессы в эндометрии и молочных железах выявляются в 2-2,5 раза чаще, чем при органическом ге-незе заболевания, у 82 % больных наряду с повышенным уровнем ПРЛ диагностируются поликистозные яичники, гирсутизм, гипе-рандрогения, нарушения жирового обмена, наружный генитальный эндометриоз, воспалительные заболевания гениталий и спаечный процесс в малом тазу.
Для больных с микроаденомами гипофиза характерна неизмененная рентгенологическая картина турецкого седла при наличии участков уплотнения в ткани гипофиза по данным томографии. Колебания уровня ПРЛ составляют 2500-10 000 мМЕ/л, пробы с метоклопрамидом и тиролиберином отрицательные. Менструальный цикл нарушен по типу аменореи (80 %) и олигоменореи (20 %), частота галактореи - 70%. Органическая патология гениталий и нейроэндокринная патология выявляются в 15 % случаев, преимущественно при олигоменорее. Эффективность терапии агонистами дофамина составляет 85 %.
Группа больных с макроаденомами гипофиза имеет патологически измененное турецкое седло: его размер увеличен, дно 2-3-кон-турное, с признаками склерозирования, нарушения целостности контуров и/или расширения входа в седло. На томограмме определяются участки повышенной плотности в области гипофиза. Уровень ПРЛ превышает 5000 мМЕ/л, пробы с метоклопрамидом и тиролиберином отрицательные. Менструальный цикл нарушен по типу аменореи (100%) и в 96% случаев сопровождается галакторе-ей. Эффективность терапии парлоделом составляет 44 % и низка при макроаденомах. У пациенток с кистозными опухолями на кра-ниограмме диагностируются патологически измененное турецкое седло и участки пониженной плотности в сочетании с уплотнением ткани гипофиза по периферии. Уровень ПРЛ аналогичен таковому у пациенток с макроопухолями, пробы с метоклопрамидом и тиролиберином всегда отрицательные. Кистозные опухоли выявляются у больных, получавших или получающих в лечебных целях парлодел. При клиническом обследовании выявляется аменорея-галакторея.
Для группы пациенток с «пустым» турецким седлом характерно несовпадение клинико-рентгенологических и гормональных параметров. При невысоком базальном уровне ПРЛ (2100-3200 мМЕ/л) турецкое седло на краниограмме патологически изменено (увеличено в размере, баллоновидное, асимметричное), на томограмме - картина «пустого» турецкого седла. Пробы с метоклопрамидом и тиролиберином отрицательные. Менструальный цикл нарушен по типу аменореи или олигоменореи в сочетании с галактореей либо без нее. Центральный генез указанных нарушений репродуктивной функции подтверждается данными изучения пульсирующей секреции гонадотропных гормонов. Определение гетерогенности патогенеза заболевания при различных формах гиперпролактине-мии составляет неотъемлемую основу выбора программы лечебных мероприятий.
Лечение. Существенное повышение эффективности лекарственной терапии нарушений репродуктивной системы, сочетающихся с гиперпролактинемией неопухолевой природы, связано с введением в клиническую практику одного из производных спорыньи - бромкриптина. Препарат обычно назначают в дозе 1,25-2,5 мг 2-3 раза в день. В очень редких случаях суточную дозировку повышают до 10-15 мг. Потенциальный дофаминерги-ческий агонистический эффект препарата может вызвать у ряда особо чувствительных пациенток развитие гипотонии и/или появление диспептических явлений в виде тошноты и рвоты. Появления подобных побочных эффектов можно избежать путем снижения начальной дозы препарата до 1,25 мг и менее, приема его после еды с еженедельным постепенным повышением дозы. Указанные побочные явления обычно исчезают после приема бромкриптина в течение первых нескольких дней. Необходимо также упомянуть, что в последующие несколько недель после окончания приема бромкриптина у части больных возможно развитие феномена последействия с умеренным возрастанием уровня ПРЛ и довольно медленным и постепенным его снижением до нормальных значений.
Прием бромкриптина в дозе 2,5 мг 2 раза в день приводит обычно к довольно быстрому восстановлению овуляторного менструального цикла, что подтверждается двухфазным характером базальной (ректальной) температуры тела, адекватным повышением уровня прогестерона в плазме периферической крови в середине гипертермической фазы цикла и секреторным превращением эндометрия. Рядом исследователей отмечено сравнительно быстрое появление овуляторных циклов после начала лечения, что свидетельствует о сохранности процесса фолликулогенеза в яичниках, несмотря на повышенный уровень ПРЛ в крови. В связи с тем, что механизм лечебного эффекта бромкриптина реализуется преимущественно на уровне гипоталамуса, описанный результат достигается вне зависимости от этиологии гиперпролактинемии. Вместе с тем в случае ме-дикаментозно обусловленной галактореи (в частности, при лечении нейролептиками психических заболеваний) для преодоления до фаминергической блокады необходимо назначение более высоких суточных доз препарата. Вопрос же о целесообразности применения бромкриптина для лечения бесплодия у больных с нормальным уровнем ПРЛ в крови до сих пор остается дискуссионным. Однако в литературе можно встретить упоминания о положительном влиянии подобного воздействия у ряда пациенток с нерегулярными и длительными маточными кровотечениями, не поддающимися традиционным методам лечения.
В клинической практике нашли применение и другие производные алкалоидов спорыньи - метерголин, абергин, норпролак, достинекс и др. Имеются данные [69], что после 10-дневного приема метерголина в дозе 4 мг/сут у больных с гиперпролактинемической аменореей существенно возрастает уровень ЛГ в плазме крови, тогда как содержание 17р-эстрадиола и, особенно, прогестерона меняется в меньшей степени. Клинический эффект указанных препаратов в некоторой степени отличается от эффекта парлодела.
По мнению большинства исследователей, при лечении пациенток с бесплодием на фоне гиперпролактинемии (без рентгенологических признаков пролактиномы) целесообразно применение малых доз бромкриптина (1,25 мг/сут) не более 3 мес. подряд. Согласно сводным данным, приводимым в ряде обзорных публикаций, под влиянием бромкриптина регулярный менструальный цикл восстанавливается у 86 % пациенток с гиперпролактинемией, галак-торея исчезает у 97 % женщин. На фоне приема препарата зачатие происходит у 80 % стремящихся забеременеть женщин.
У пациенток с микропролактиномами уровень ПРЛ снижается в такой же степени, как и при функциональной гиперпролактинемии, при приеме бромкриптина в дозе 2,5 мг 2 раза в день. Одновременно происходит обратное развитие признаков гипогонадизма. Действие бромкриптина на снижение уровня ПРЛ обратно пропорционально степени гиперпролактинемии. Нередко возникает необходимость использовать более высокие дозы препарата; в этих случаях нужно обратить особое внимание на то, чтобы больная принимала его во время еды, во избежание постуральной гипотензии и диспептиче-ских явлений. Лечение рекомендуется начинать с приема 1,25 мг в вечернее время с последующим приемом указанной дозы 3 раза в течение следующего дня. Каждые 4 дня дозу препарата повышают до достижения нормального уровня ПРЛ в крови. Суточную дозу абер-гина подбирают индивидуально - от 4 до 16 мг/сут на 2-3 приема во время еды. Побочной реакцией препарата является гипотоническое действие, которое выражено в меньшей степени, чем при приеме других препаратах бромкриптина. Подобный медикаментозный метод лечения в определенной степени конкурирует с селективной гипофизэктомией или лучевым воздействием и нередко используется в сочетании с ними.
У пациенток с макропролактиномами также проводят медикаментозное лечение, однако в этих условиях не всегда удается добиться нормализации уровня ПРЛ в крови путем применения больших доз препарата. На первом этапе лечения при макропролактиномах с увеличением турецкого седла чаще прибегают к медикаментозной терапии до хирургического вмешательства, особенно у стремящихся к беременности женщин. Вместе с тем лечение бесплодия, сочетающегося с гиперпролактинемией, требует особого внимания, ибо во время беременности происходит увеличение размера пролакти-номы. У части пациенток с интраселлярной пролактиномой беременность после соответствующего лечения нередко протекает без осложнений, а бессимптомное развитие инфарктов в ткани опухоли у ряда женщин может способствовать спонтанному восстановлению овуляторного цикла. Имеются данные, что осложнений со стороны опухолей значительного размера при беременности удается избежать путем проведения медикаментозного лечения до беременности, поскольку производные алкалоидов спорыньи оказывают на опухоль антипролиферативный эффект.
В последние годы для лечения гиперпролактинемических состояний применяют препарат достинекс, 1 таблетка которого содержит 0,5 мг каберголина. Препарат обладает выраженным и длительным пролактинснижающим действием, в связи с чем назначается после индивидуального подбора минимально эффективной дозы (чаще 1-2 таблетки в неделю) с регулярным (1 раз в неделю) определением уровня ПРЛ в сыворотке крови.
Нормализация уровня ПРЛ при гиперпролактинемии имеет не менее важное значение и в течение ранних сроков беременности у страдающих привычным невынашиванием женщин. В литературе приводятся сведения о том, что в популяции женщин с привычным невынашиванием беременности нарушения секреции ПРЛ в качестве основной и единственной причины этой патологии могут встречаться в 18-20 % наблюдений. Благоприятные же исходы беременности и рождение живого плода, согласно данным рандомизированного исследования, отмечены среди леченных бромкриптином женщин в 85,7 % случаев, а среди нелеченных - в 52,4 %.
У больных с первичным гипотиреозом и гиперпролактинемией, в том числе и при увеличении размера гипофиза вследствие вторичной гиперплазии тирео- и лактотрофов, 1-й линией лечения должно быть назначение препаратов тиреоидных гормонов. После ЗГТ L-тироксином (100 мкг/сут) состояние эутиреоидизма и, соответственно, нормализация функции яичников наступают уже после первых 3 месяцев лечения. К назначению парлодела прибегают лишь при недостаточном клиническом эффекте [207].
Прогноз и профилактика. Согласно материалам наблюдений, проведенных в НЦ АГиП РАМН [61], эффективность комплексной поэтапной дифференцированной терапии бесплодия при гипер-пролактинемии составляет 79,7%, причем течение беременности и родов не зависит от причин этой патологии. Отмечено, что показатели физического и нервно-психического развития, заболеваемость и социальная адаптация детей, рожденных от матерей с гиперпролактинемией, свидетельствуют об отсутствии негативного влияния заболевания и приема агонистов ДА на потомство. Проведенные соответственно целенаправленной терапии беременность, роды и лактация не оказывают отрицательного действия на течение гипер-пролактинемии. Течение заболевания в послеродовом периоде в основном определяется характером регрессивных изменений в лак-тотрофах гипофиза, развивающихся под влиянием лечения агониста-ми дофамина. Диспансеризация данного контингента больных после родов и своевременно начатое лечение парлоделом предупреждают рецидив заболевания в отдаленные сроки у 89,5 % женщин [61].
В данном разделе были рассмотрены некоторые аспекты проблемы гиперпролактинемии в клинике нарушений репродуктивной функции. Необходимо еще раз подчеркнуть, что широкое распространение этой патологии в женской популяции требует определенного внимания к данному феномену при ведении различных категорий гинекологических больных.
М.Н. Буланов. Ультразвуковая диагностика в гинекологической практике
Методика обследованияТрансабдоминальное исследование (ТАИ) внутренних женских половых органов с наполнением мочевого пузыря целесообразно проводить с учетом следующих правил: пациентка выпивает 1 литр жидкости за 1-2 часа до обследования (для ускорения подготовки возможен прием фуросемида). При метеоризме - в течение 2-3 дней до исследования принимается активированный уголь и эспумизан. К преимуществам ТАИ следует отнести в первую очередь возможность стратегического обзора органов малого таза с получением представления о топографии нормальных и патологических образований малого таза (рис. 1) и брюшной полости в целом.
Рисунок 1 Матка.
Матка.Закончился мой цикл в 53 дня 😰в какой то мере я обрадовалась и вздохнула, но не тут то было... сегодня на 6дц была у врача, сдала гормоны первой фазы и узи где показали, что тот доминантный фолликул, который был в прошлом цикле 24мм остался и до сих пор...
Хочу поделиться опытом и, возможно, предостеречь планирующих девушек от негативного влияния лапароскопии на овариальный резерв.
Девочки, у меня тут тревоги небольшие ..После очередного пролёта назначили гистеру с рдв. Собирала анализы для направления и на узи на 8дц увидели доминантный фолликул 1,7 см.цикл 30 дней и что-то он рано у меня созрел до таких размеров.у узистки о...