Пузырный занос: симптомы на ранних сроках
Общая часть
Совершенствование и широкое внедрение в клиническую практику современных методов оценки состояния и развития плода позволили значительно улучшить диагностику и выбор оптимальной акушерской тактики с целью снижения перинатальной заболеваемости и смертности. Среди многочисленных методов наибольшее практическое значение в настоящее время имеет ультразвуковое исследование. Неинвазивность и безвредность УЗИ, его высокая информативность способствовали тому, что эхография стала одним из ведущих методов исследования в акушерстве.
Одним из основных направлений ультразвуковой диагностики в акушерстве является исследование в ранние сроки беременности. Однако, использование ультразвукового скрининга в первом триместре беременности до 10 недель с экономической и практической точек зрения не оправдано, кроме того, нельзя полностью исключить возможное неблагоприятное влияние УЗ как физического фактора на процессы эмбриогенеза и развития беременности в целом. Поэтому УЗИ в первом триместре беременности до 10 недель проводится строго по показаниям:
осложненное течение беременности (угроза прерывания, кровянистые выделения),
подозрение на неразвивающуюся и внематочную беременность,
перенесенные инфекционные заболевания и воздействие тератогенных факторов,
миома матки, новообразования яичников,
сочетание внутриматочного контрацептива и беременности,
отягощенный акушерско-гинекологический анамнез (невынашивание беременности).
При УЗИ в ранние сроки следует стремиться к минимально возможной экспозиции на одном определенном участке.
В ходе УЗИ в первом триместре беременности осуществляют:
Установление маточной беременности на основании визуализации плодного яйца с эмбрионом или без эмбриона в полости матки.
Биометрию (средний внутренний диаметр плодного яйца, копчиково-теменной размер эмбриона) - КТР.
Оценку жизнедеятельности эмбриона (сердечная деятальность, двигательная активность).
Определение локализации хориона и исключение его патологии.
Изучение экстраэмбрионарных образований.
Исследование анатомии эмбриона/плода.
Оценку внутреннего зева.
Визуализацию стенок матки и придатков.
У пациенток с регулярным менструальным циклом в ультразвуковом заключении используется акушерский срок беременности (по первому дню последней менструации).
Я и как вы читала истории про девочек, которые долго шли к своей беременности и у них получилось. Я за них радовалась, а иногда и завидовала, но думала это у других так получается, а у меня такого не выйдет, ведь я взрослая и уже не верю в чудеса.... А зря! :) Много букв,буду подробно всё описывать, может это кому-то поможет, далее подкат ..
Активно начали планировать вторую беременность с 01.09.2011 года. На тот момент нашей дочери было 8 лет. Я хотела начать планировать раньше, но муж говорил- не сейчас, на работе проблемы, неизвестность, вдруг уволят, вот будет стабильно потом и начнем. На тот момент я стабильно работала и стабильно получала з/п, но имели 1 ипотечный кредит и обычный кредит. Мне было полных 28 лет, года шли.. С год я его прибалтывала на планирование (первый ребенок у нас быстро получился, со второго цикла планирования. Молодость, в 19 лет)). В начале августа 2011 года муж согласился, что можно планировать. На тот момент у меня стояла спираль (1,5 года стояла). Мне ее убрали, сказали месяц предохранятся, сдать анализы, начать пить фолиевую кислоту. Я всё делала по инструкции Г. Анализы в норме.
С начала сентября перестали предохранятся и начались дни ожидания. У меня же всё хорошо, быстро получается. Я уверенная в себе! Отпраздновала 29-летие. Цикл за циклом, а задержки нет. Тесты отрицательные. Тесты я обычно начинала делать до задержки, при цикле в 28 дней ровно. Числа 11 января 2012г, за 4 дня до М. делаю тест и вижу //. Я рада, показываю мужу, он тоже рад. Всё замечательно, останется выждать 9 месяцев и УРА.. 20 января (срок примерно 5 недель) встаю на работу как обычно иду в туалет... и на салфетке вижу красный развод. Я напугана, говорю мужу, что делать?! На работе еще никто не вкурсе, как быть..., но ребенок важнее! Я вызываю скорую, меня везут в дежурную гинекологию. Там смотрят, говорят- срок маленький ничего не видно, матка слегка увеличена. Ставят ношпу, оформляют в стационар, дают направление пройти у них же узи.
Узи показывает, что плодного яйца НЕТ, но есть жидкость в позадиматочном пространстве. У меня спрашивают- вы тест делали? Я - естественно. Узистка - сколько раз? Я - одни, а зачем больше, он же положительный был 0_0. Отправляют к Г. Гинеколог проводит опрос, записывает, говорит что нужно сдать кровь на хгч ( у них же) и говорит пока не завтракать. Я сдаю, жду. Разрешают позавтракать со всеми. Жду.. Приходит и говорит, чтобы подтвердить беременность нужно сделать прокол через матку ( взять пункцию) той жидкости которая позади матки. Ну раз надо, значит надо. Мазать от ношпы и чего то еще перестает, боли нет!!! Идем брать пункцию. Длинной иглой мне не с первого раза делают прокол. Боль ужасная!!!! Отправляют в палату, у меня всё закровило, течет... Врач говорит, что подозрение на внематочную! После обеда, часа в 3 мне говорят результат. Что пункция и хгч показали что беременность есть но не в матке. Нужно делать лапароскопию, смотреть где беременность. Что скорее всего в трубе и что во время операции мне её удалят. Я плачу. Говорю, что может ли быть что ошиблись и просто срок маленький и что если Б в норме ее мне оставят?! Врач говорит- да конечно, просто зашьют и всё. Я еще раз к Г., а вы можете не удалять трубу если это трубная беременность, просто прочистить...или еще каким то способом. Она выпучив на меня глаза - нет конечно, так не делают, ведь труба очень маленькая, как тут вычистишь.... ((
Меня начали готовить к операции. А поскольку я в этот день кушала, мне сначала начали чистить желудок. Медбрат заталкивал в меня шлангочек, типа капельницы, вызывая рвоту. Я и задыхалась при этом и извивалась, хватала его. Процедуру кое как окончили.... Операция под наркозом ( в руку ставили) отключалась полностью.. Результат: Трубная беременность с правой стороны. Удалили трубу. Шок. я в трансе, в печали. Далее 6 месяцев предохранения ОК, сдача анализов на ИППП ( всё в норме). Сразу после удаления , недели через 2, прохождение реабилитации, чтобы исключить повторения. Делала магнит, физио.
25.06.12 делаю эхометросальпингографию, проверка прохождения в трубе раствора под контролем Узи. Заключение: Слева за маткой определяется жидкость. т.е. труба проходима! Ура, я полна сил и надежды! Назначают фолиевую кислоту, витамин Е и йодомарин. и отпускают планировать! :) Циклы ожидания, узи, контроля.. Цикл ровный 28 дней.
30.10.12г начало очередных М, у меня вскоре Д,Р. Я стараюсь отвлечься от планирования, активно к нему готовлюсь 30летие же. Праздную, веселюсь. Но до задержки делаю тесты, так на всякий случай ;) И вот за 2 дня до М у меня // ! Я волнусь делаю еще тест через день, он чуть ярчает. Я рада! Бегу на Узи в день задержки, чтобы подтвердить маточную Б. Там мне говорят, Б не видно, еще рано, контроль через 7-10 дней. Это были самые длинные дни! 11.12.12г Иду с мужем делать узи, страшно аж жуть. Подтверждают маточную беременность, срок 4-5 недель и ставят угрозу! Плодное яйцо вытянутой формы (деформировано). Меня направляют в стационар на сохранение. Там я лежу, встаю только в туалет, дают дюфастон. Через неделю на контроль УЗИ. У меня не хорошие предчувствия, так как одним из признаком беременности у меня дико начинали болеть соски, а тут по болели и перестали.. Узи- плодного яйца -нет!! Я плачу навзрыд! Врач говорит - узи показала, что стенки матки подозрительно очень тонкие, при чистке можем не сохранить матку и придется её удалить и возможна большая потеря крови. А это без надежд! Я по телефону говорить не могла, только ревела, муж прилетел, я ему пыталась сказать, но немогла, слёзы перехватывали дыхание..... Чистка 20.12.12г
Матку сохранили. Во время чистки врач сказала, что плодное яйцо было почти на выходе, что если бы не сохранение, оно бы вышло само, но помимо этого в матке обнаружили пузырики. Подозрение на пузырный занос. Меня успакаивают и говорят, что это похоже на рак, но это лечится и посе курса химиотерапии известны случаи удачной беременности. Мне делают флюраграфию для исключения метостаз. Их нет. После чистки у меня дней 5 держится температура по 39 градусов. Мне дают сильные антибиотики и сильные колят. Температуру сбивают. Меня выписывают 29.12.12г С дальнейшем контролем в онкологической больнице. Хожу на контроль хгч, он падает.
В период планирования беременности у меня умирает папа от рка. Что такое рак и сколько боли и мучения он приносит больному и близким я знала не понаслышке. В новый год я иду уже без слез, только с молитвами (медицина в раке без сильна). Я ни близким, ни друзьям об этом не говорю, с мыслями не делюсь, не плачу. Иду в новый год, что я не позволю переживать за меня родным и при необходимости я просто потеряюсь, уйду из дома. Я не хочу чтобы им было больно из-за меня. За себя я уже не переживала...
Я при всех улыбаюсь, шучу, на крещение иду впервые в прорубь и окунаюсь. Это было незабываемое ощущение. Я почувствовала, что внутри меня появилось что то светлое, чистое, как второе дыхание. Мне сложно описать это ощущение, но почувствовала жизнь!
После январских праздников я иду в онкологический диспансер к гинекологу. Она читает выписной эпикриз и говорит - чушь какая то. Смотрит мой контроль хг ч, его падение. И говорит, диагноз мне не понятен, мне нужны стекла с той Ж/Д больницы, где чистили и мы проведем свой анализ. А пока я у вас вижу маленькую эрозию, её нужно удалить (вырезать). Я несу стекла в онкологию, вырезают мне эрозию.. В конце января 2013г мне выдают новый результат, что никакого пузырного заноса у меня нет и небыло! Эрозию мне так убрали. что от нее не осталось и следа! И меня отпускают на свободу)
В дальнейшем мы жили ППА.. В мае я иду к Г и меня отправляют сдать на все инфекции и гормоны. Всё в норме, разрешили планировать. Но у меня началось что-попало с циклопом, началась мазня дней за4-5 до М, после М. Я старалась на это не обращать внимание. Полетели на море, старалась отвлечься и там планировать.
20.07.13г я иду к другому Г и там мне ставят подозрение на наружный эндометриоз и советуют диагностическую лапароскопию с последующем ОК на 3-6 месяцев.
26.08.13г мне делают диагностическую лапароскопию. Диагноз: Наружный и внутренний эндометриоз. Хронический левосторонний сальпингит, ремиссия. Спаечная болезнь брюшины. Кто если читал про эндометриоз, то знают что там есть стадии и различия и должны описать эндометриоз чего именно, т.е. где очаги. Мне этого не написали, а на словах врач сказал, - ну даа, еесть эндометриоз. Меня марально эта операция не удовлетворила.
Далее 3 месяца ОК Ярины. Опять аналы по окончанию приема ОК. Но я в надежде, что всё хорошо. Стараюсь отвлечься и до мая месяца ничего не делаю и не зацикливаюсь!
А ребеночка то хочется, а он не получается... (
В мае 2014г сдаем спермограмму, она в норме- нормозооспермия! Я начинаю сидеть на ББ, учится что к чему, как ошибаются врачи и как планируют другие. И оказывается я не одна такая! В июне мне предлагают попить дюфастон (я его пью со 2.06.14 по 25.10.14 чтобы боле-менее нормализовать цикл ) подозрение на эндометрит. Я говорю, давайте проверим пайпель-биопсией. Врач соглашается. Приходит гистология и эндометрит не подтверждается! Мне предлагает простимулировать яичникии сделать укол хгч ( а вдруг поможет) А на тот момент я уже просыпалась с градусником в *опе и знала, что овуляция у меня есть каждый месяц и ничего я стимулировать не собираюсь, что это может истощить яичники. И я ухожу от это Г. И начинаю слушать своё тело читать активно ББ. Я знала что такое ЯБ и что такое ИП. Я чувствовала когда у меня О.
Но Б так и не наступала..((
в апреле 15г мне рекомендуют нового Г. Я в ней почувствовала своего врача. Мне нравился ход её мысли. Я ей доверилась. Когда я к ней пришла, и принесла свою папку с делом она меня встретила со словами, а вы зачем ко мне пришли. У вас и так все проверено, вы уже много прошли... Я ей сказала-вы последняя надежда. Она - тогда начнем всё сначала.
18.04.15 - проверка проходимости трубы при помощи снимка, а не узи. Труба проходима, но извита! Яичники в норме! Анализы показывают что у меня ЦИН-1, подробное изучение выявляет что у меня уриаплазма ( норма допустимая, но есть) , муж сдает и тоже выявляется, но чуть больше. Нам прописывают антибиотики азитромицин 500-6 дней, свечи 14 дней и через месяц контроль. Мы допиваем антибиотики и летим на море, отдых, секс! Прилетаем контроль уреаплазмы... и она не прошла..(( опять антибиотики. Я прохожу магнит ( физиолечение). Сдача уреаплазмы - все прошло! Мне она рекомендует грязелечение, вагинально сама ввожу грязи спец шприцом, лежу и потом подмываюсь.
август 2015г
Подозрение на полип эндометрия, рекомендует пройти гистероскопию.
При этом в диагнозе она пишет: Бесплодие 2, неуточненное. Хр.эндометрит , Бактериальный вагиноз.
сентябрь 2015г. Провели гистероскопию. Полип не подтвердился. Из гистологии: эндометрий пролиферативного типа с очаговой дискомплексацией желез за счет фиброза ... на фоне хронического вялотекущего эндометрита. Никакого эндометриоза- нет! Мне назначили свечи и отправили планировать.
в октябре я в поледний раз измеряю БТ и перестаю читать ББ, мне нужно отвлечься, я стараюсь. К тому же на носу защита диплома и подготовка к нему.
Врач сказала- всё что можно было сделать, мы сделали. Тянуть некуда. в ноябре исполнится 33 года. Если до января 16г не забеременеешь нужно готовить документы на ЭКО.
Не думать совсем о планировании не получается! Даже отвлекаясь на подготовку и защиту диплома, а потом к НГ и кучей работы на работе всё равно, это не выкинуть из головы!
И так что дало результат я не знаю может все понемногу. Вот что я сделла, последние штрихи:
Наступал НГ, а Б так и небыло. Каждый год под бой курантов я загадывала желание выпиваю бокал шаманского , в ночь с 6 на 7 января в 12:00 я вышла на улицу, подняв голову и посмотрев в ночное небо из за всех сил пожелала родить в этом году. Каждый день, примерно с декабря месяца я стала мазать живот ( в виде креста) маслом от Матроны Московской, часто ходила в церковь и просила её. и около копьютера стояла её икона.
январь 2016г. Нужно идти к Г и планировать ЭКО. Но нужно спланировать разговор с мужем, а я дико волновалась. Информацию по ЭКО уже почти собрала, выписала фио врачей и стоимости. А с мужем говорить, страшно. Начало года, а я вся не свая, взвинченая, в печали что никак не получается. Нашла момент и начала с ним говорить, а он мне - согласен ждать еще год , два, пять, но ЭКО не за что! Я не готов рисковать здоровьем твоим. А это риск. Нам и так хорошо, у нас есть дочь и я вас люблю, но на это не согласен...
И я его поняла, услышала, приняла его мнение.
По воле судьбы в наш коллектив пришла девушка 30 лет, которая не может заберемененть около 6 лет. И я услышала. что она ездит к одной бабушке, лечится.
Мне терять было нечего. И я прошусь с ней поехать и беру с собой мужа.
Бабушка смотрит мужа, говорит ему про его болячки, назначает попить сбор трав. По активности спермы говорит- что не в идеале, но с таким забеременеть можно. Смотрит меня и говорит, что у меня что-то там поддорвано, что нужно пропить травки и через месяц к ней. Сразу скажу, что я не особо поверила. Но мало ли...
Забыла написать, что в этом году я опять пошла на крещение в прорубь! Ездила в обеденный перерыв и в -20 окуналась!
февраль 2016г я активно начала заниматься спортом, раньше я например не одевала шорты для похудения ( чтобы сильно не потеть), не качала пресс после О. В это раз я забила, я помнила когда О и т.д. просто не старалась беречься. И пила травки которые прописала бабушка. БТ я не мерила!!! На форуме здесь не сидела!!!. А зачем, если не получается. Но где-то глубоко в душе, я знала, что раз мне не напиали что я физиологически не могу быть беременной, что когда нибудь у нас получится! Я морально, как бы приняла свое тело! В крайней цикл: У меня М начались с мазни, дня 3 мазало ( может из-за травы) я ее перестала пить и на следующий день у меня пошли нормально. Я уехала в командировку и по приезду у меня должна была быть О на днях. Обычно во время О или перед О, перед начало секса ( простите за подробности, но может это кому-то пригодится) я старалась чтобы моя слюна не попала на ч*н мужа, т.е. без орала перед секса, а тут я соскучилась и я старалась не соблюдать этих правил. После секса я старалась лежать, а тут я на этом старалась не зацыкливаться. и кончно я в этом цыкле через день ходила в тренажерный!
Месяц на траве заканчивался и мы поехали к бабушке. Она посмотрела и сказала, но на много лучше стало, - думаю еще разок приедешь и все получится. На тот момент задержки еще не было! на выходных съездили, в понедельник я пошла закупать новый сбор трав и на всякий случай купила тест. Вечером я собиралась идти в тренажерный и брать новый, больший вес. И в обеденный перерыв я сделала тест ( не держа в баночке как обычно и считая секунду) а так, под попис)) и заталкала в карман и пошла в кабинет. Прийдя в кабинет я увидела //. Шок, я не поверила, думаю не может быть. М должны были быть в среду! Грудь и соски не болели вообще! Тишина и никаких симптомов. Я подумала что тест бракованный и утром его повторила. А там опять //!. Вы думали я тут поверила своему счастью, нееет! Я не могла поверить, что это произошло до первого скриненга! Вот там были слёзы счастья!
Девочки, милые, найдите свой путь. Я не могу сказать, что это панацея,что то что помогло мне поможет и вам. Я думаю у каждого свая дорога. Но я надеялась, что когда-нибудь это произойдет!
И аапчииии на Вас!!
Забеременев, женщина сдает множество анализов, причем некоторые даже по несколько раз. Это может стать причиной для беспокойства: может быть, что-то не так? Одним из таких анализов, которые, возможно, придется сдавать неоднократно, является анализ ХГЧ при беременности.
Что такое ХГЧ
ХГЧ (хорионический гонадотропин человека) – это гормон, выделяемый хорионом после прикрепления оплодотворенной яйцеклетки к стенке матки. Происходит это практически с момента зачатия, поэтому именно ХГЧ является надежным показателем при ранней диагностике беременности, при условии, что результат анализа является достоверным.
Тогда для чего измеряется уровень ХГЧ при беременности не только в 1-м, но и во 2-м, и даже 3-м триместре? Дело в том, что существуют определенные нормы показателей ХГЧ в различные периоды беременности, позволяющие выяснить, нормально ли она протекает и нет ли у плода каких-нибудь патологий.
В состав ХГЧ входят альфа- и бета-частицы. Именно бета-единица имеет уникальную структуру, поэтому имеет значение как раз b-ХГЧ при беременности. Данное лабораторное исследование может проводиться уже на 2-3 день задержки менструации, если зачатие произошло, и с этого момента прошло уже 6-10 дней, уровень ХГЧ обязательно будет повышенным. Если нужна более высокая точность, рекомендуется повторение анализа и ультравагинальное УЗИ.
Кстати, домашние экспресс-тесты на беременность (что бы мы без них делали?) тоже основаны на выявлении ХГЧ при беременности, правда, на гормон, содержащийся не в крови, а в моче, где его концентрация вполовину ниже, поэтому и точность такого метода уступает лабораторному обследованию, но все же является достаточно достоверной.
Уровни ХГЧ при беременности
После оплодотворения яйцеклетки ее внешняя мембрана (хорион) начинает активно выделять гонадотропин, причем очень быстрыми темпами: в 1-м триместре уровень ХГЧ при беременности каждые 2 дня увеличивается вдвое. На 7-10 неделе этот показатель достигает своего пика, а потом постепенно снижается, не изменяясь существенно во 2-й половине беременности. Вот почему по скорости роста ХГЧ при беременности врачи могут судить о ее нормальном развитии или отставании. На 14-18 неделе этот показатель может сигнализировать о развитии патологии. Поэтому назначая этот анализ повторно, ваш врач просто перестраховывается, поэтому не пугайтесь.
Что же касается норм ХГЧ, то это весьма относительное понятие. Дело в том, что практически в каждой лаборатории установлены свои нормы. Для примера приведем таблицу норм ХГЧ, она поможет вам приблизительно сориентироваться в этом вопросе. Однако помните, что решающие слово о соответствии или отклонениях от нормы ваших анализов, может сказать только квалифицированный специалист.

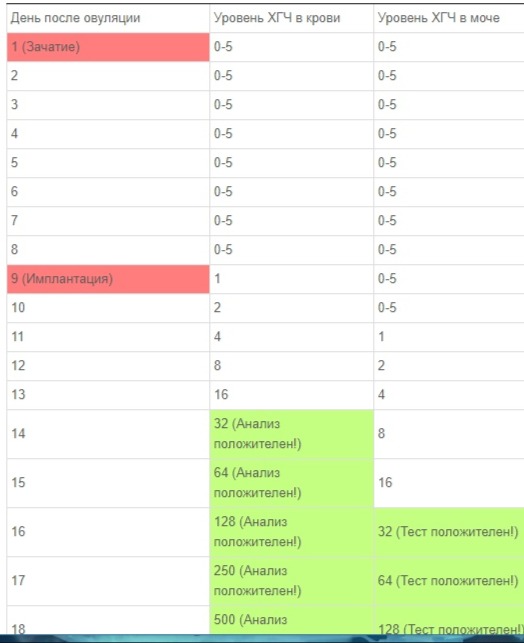
Нормы уровня ХГЧ по дням после овуляции

Отклонения от нормы ХГЧ при беременности
А что, если анализ ХГЧ при беременности показал некое отклонение от нормы в ту или иную сторону? Конечно, это не слишком хорошо - и повышенный, и пониженный показатель должен насторожить, ведь все это свидетельствует о каких-то проблемах и осложнениях в организме женщины. Главное убедиться, что срок беременности установлен правильно, иначе сравнение с нормой потеряет всякий смысл.
Слишком высокий уровень ХГЧ при беременности – это, в лучшем случае, показатель многоплодной беременности: обычно уровень гормона в крови увеличивается пропорционально количеству эмбрионов.
Кроме того, уровень ХГЧ выше нормы может указывать на следующие патологии:
- ;
- ;
- аномалии развития плода, например, синдром Дауна;
- перенашивание беременности.
Уровень ХГЧ может повыситься, если будущая мать страдает сахарным диабетом и принимает синтетические гестагены.
Ложноположительный результат анализа ХГЧ
Если выясняется, что вы не беременны, а уровень ХГЧ высок (ложноположительный результат анализа), возможно, на него повлиял один из следующих факторов:
- прием некоторых гормональных препаратов, в том числе оральных контрацептивов;
- остаточное явление после предыдущей беременности или аборта;
- хорионкарцинома;
- пузырный занос или его рецидив;
- опухоль яичников, матки, почек, легких.
В любом случае это – повод для обращения к врачу.
Пониженный ХГЧ при беременности может свидетельствовать о внематочной беременности, об угрозе выкидыша, перенашивании. Также это может являться симптомом такого неприятного явления, как хроническая плацентарная недостаточность.
ХГЧ при замершей беременности
Также уровень ХГЧ падает при замершей беременности. Замершая или регрессирующая беременность - это случай, когда плод по тем или иным причинам погиб. Гормон перестает вырабатываться, и анализ показывает падение уровня ХГЧ. Обычно при подозрении на замершую беременность проводится исследования в динамике, то есть анализы сдаются несколько раз, а врач наглядно может определить, как изменяется уровень гормона в крови.
Однако не спешите паниковать – возможно, показатели ХГЧ выходят за пределы нормы для вашего срока беременности лишь потому, что он был установлен неправильно. Такое случается, поэтому для определения регрессирующей беременности назначается УЗИ, только не его основе выносится окончательное заключение. Кроме того, известны случаи, когда при замершей беременности ХГЧ растет, хотя другие признаки уже сошли на нет.
Иногда результаты анализа показывают ХГЧ 0 (отрицательный) при беременности, скорее всего – это тоже ошибка и вам нужно будет сделать анализ повторно.
Как сдавать анализ на ХГЧ
Для того чтобы анализ был максимально точным и достоверным, его нужно правильно сдать. О том, как подготовиться к этому, вам сообщит ваш врач, но знайте, что анализ на содержание в крови b-ХГЧ при беременности сдается натощак. Чаще всего рекомендуют делать это утром, но можно и в другое время суток – при условии, что до этого вы ничего не ели в течение 4-6 часов.
Кровь сдается из вены. За день до этого исключите физические нагрузки – так результат будет более достоверным. Важный момент - если вы принимаете гормональные препараты, они обязательно повлияют на результат анализа, поэтому не забудьте сообщить об этом сотруднику лаборатории, где вы будете сдавать кровь.
В любом случае, даже если результаты анализа на ХГЧ настораживают вас, не спешите паниковать, не делайте далеко идущих выводов – правильно интерпретировать показатели может только врач, который расскажет вам, что делать дальше и, возможно, назначит повторный анализ.
Результаты анализов крови
Это попытка расшифровать результаты некоторых анализов крови, которые делаются в современных лабораториях.
 Кровотечение в первой половине беременности - частая патология, способная привести к серьезным последствиям.
Кровотечение в первой половине беременности - частая патология, способная привести к серьезным последствиям.
К сожалению, многие женщины, наслушавшись рассказов о возможных месячных после зачатия, игнорируют появление выделений с небольшой примесью крови.
Результат в этом случае нередко оказывается плачевным: женщина теряет ребенка и подвергает опасности собственную жизнь.
Общая часть
Совершенствование и широкое внедрение в клиническую практику современных методов оценки состояния и развития плода позволили значительно улучшить диагностику и выбор оптимальной акушерской тактики с целью снижения перинатальной заболеваемости и смертности. Среди многочисленных методов наибольшее практическое значение в настоящее время имеет ультразвуковое исследование. Неинвазивность и безвредность УЗИ, его высокая информативность способствовали тому, что эхография стала одним из ведущих методов исследования в акушерстве.
Одним из основных направлений ультразвуковой диагностики в акушерстве является исследование в ранние сроки беременности. Однако, использование ультразвукового скрининга в первом триместре беременности до 10 недель с экономической и практической точек зрения не оправдано, кроме того, нельзя полностью исключить возможное неблагоприятное влияние УЗ как физического фактора на процессы эмбриогенеза и развития беременности в целом. Поэтому УЗИ в первом триместре беременности до 10 недель проводится строго по показаниям:
осложненное течение беременности (угроза прерывания, кровянистые выделения),
подозрение на неразвивающуюся и внематочную беременность,
перенесенные инфекционные заболевания и воздействие тератогенных факторов,
миома матки, новообразования яичников,
сочетание внутриматочного контрацептива и беременности,
отягощенный акушерско-гинекологический анамнез (невынашивание беременности).
При УЗИ в ранние сроки следует стремиться к минимально возможной экспозиции на одном определенном участке.
В ходе УЗИ в первом триместре беременности осуществляют:
Установление маточной беременности на основании визуализации плодного яйца с эмбрионом или без эмбриона в полости матки.
Биометрию (средний внутренний диаметр плодного яйца, копчиково-теменной размер эмбриона) - КТР.
Оценку жизнедеятельности эмбриона (сердечная деятальность, двигательная активность).
Определение локализации хориона и исключение его патологии.
Изучение экстраэмбрионарных образований.
Исследование анатомии эмбриона/плода.
Оценку внутреннего зева.
Визуализацию стенок матки и придатков.
У пациенток с регулярным менструальным циклом в ультразвуковом заключении используется акушерский срок беременности (по первому дню последней менструации).

Установление маточной беременности
Для проведения трансабдоминального сканирования в ранние сроки используется стандартная методика "наполненного мочевого пузыря" Для ультразвукового исследования плода чаще используются линейные и конвексные датчики с частотой 3,5 - 5 МГц.
Диагностика маточной беременности возможна при акушерском сроке
5 - 6 недель, т.е.когда задержка менструаций при регулярном менструальном цикле составляет 1 неделю и больше.
Плодное яйцо - анэхогенное образование округлой формы в верхней трети полости матки, при беременности 5 - 6 недель его средний диаметр 5 - 7 мм, оно окружено венчиком повышенной эхогенности.
Эмбрион визуализируется с 7 недель беременности в виде высоко- эхогенной линейной структуры в полости плодного яйца. Использование трансвагинальной эхографии позволяет обнаружить плодное яйцо и эмбрион значительно раньше: плодное яйцо визуализируется при 2-3 дневной задержке менструаций, т.е. с 4-5 недель акушерского срока, его диаметр при этом составляет 2-4 мм. С 5 недель визуализируется эмбрион - гиперэхогенная линейная структура 3мм. Исследование осуществляется при опорожненном мочевом пузыре.
Следует помнить, что отсутствие эхографического изображения плодного яйца в полости матки при задержке менструации в 1 нед, не позволяет окончательно исключить наличие беременности малого срока. Повторное исследование через 3-4 дня прояснит все вопросы. Поэтому клиницисты, направляющие беременых на исследование, должны быть осведомлены об ограничениях метода и оценивать результаты только в комплексе с другими методами исследования и клиническими симптомами.
Биометрия в ранние сроки
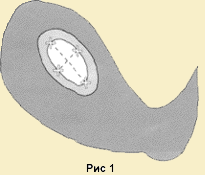
При неосложненной беременности достаточно ограничиться измерением среднего внутреннего диаметра плодного яйца и КТР эмбриона. Измерение размеров матки (длина, передне-задний размер, ширина) имеют значение при гипоплазии матки, кроме того, индивидуальные параметры этих показателей очень велики.
При продольном сканировании измеряют длину и передне-задний размер плодного яйца, ширину - при поперечном сканировании (Рис. 1). Все измерения проводят строго по внутрен- нему контуру. Из 3-х полученных численных значений вычисляют средне-арифметическое, оно и является средним внутренним диаметром плодного яйца. Ошибка составляет ± 6 дней.
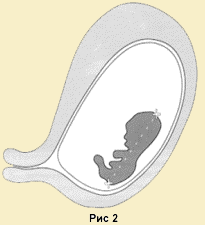
КТР (копчиково-теменной размер). Для его измерения необходима четкая визуализация эмбриона. Измеряется максимальная длина эмбриона от его головного конца до копчика в момент максимального разгибания (Рис. 2). Ошибка при этом не превышает ± 3 дня. Измерения повторяют трехкратно, за истинное значение принимают максимальное значение (можно среднее арифметическое). Для определения срока беременности по полученным результатам пользуются разработан- ными нормативами или формулами, заложенными в програмное обеспечение.
Оценка жизнедеятельности эмбриона
Признаки жизнедеятельности эмбриона: сердечная деятельность и двигательная активность. Двигательная активность появляется после 7 недель беременности (сначала слабые и единичные, непродолжительное время, затем сгибательные и разгибательные движения эмбриона, позже - движения конечностей и наконец - генерализованные движения. Периоды двигательной активности сменяются периодами покоя.
Регистрация сердечной деятельности возможна с 6 нед беременности (трансвагинально - с 5 недель). Рекомендуется использовать М-метод или допплеровский режим. Оценка частоты сердечных сокращений (ЧСС) эмбриона. Последняя постепенно возрастает от 110 - 130 уд/мин в 6 - 8 нед до 200 в 9 - 10 нед. Значения ЧСС эмбриона важны для прогнозирования дальнейшего течения беременности в первом триместре. Так, ЧСС 100 уд/мин и менее после 9 нед - неблагоприятный признак. Согласно этому критерию с высокой чувствительностью и специфичностью можно прогнозировать самопроизвольный аборт. ЧСС эмбриона менее 85 в сроке 5 - 8 недель - крайне неблагоприятный признак. Необходимо подтверждать нарушения ЧСС эмбриона в динамике с интервалом в несколько дней для исключения возможного влияния особенностей развития парасимпатической нервной системы.
При сомнении в признаках жизнедеятельности эмбриона до 8 нед необходимо провести контрольное исследование через 1 нед. Тогда все вопросы решаются без особых затруднений.
Изучение экстраэмбриональных образований
Желточный мешок определяется с 6 недель, как округлое тонкостенное анэхогенное образование в непосредственной близости от эмбриона
4 - 8 мм в диаметре, постепенно увеличиваясь до 10 мм, после чего подвергается обратному развитию: стенки спадаются и он превращается в высокоэхогенный пристеночный компонент. После 12 недель не визуализируется. При его отсутствии беременность нередко заканчивается самопроизвольным абортом. Преждевременное его исчезновение - неблагоприятный признак, часто при неразвивающейся беременности.
Эмбрион располагается в амниотической полости и отделен от хориальной нежной тонкой мантией. К концу первого триместра оболочки сливаются. Желточный мешок визуализируется в хориальной полости, а эмбрион-в амниотической.
Следует обратить внимание на величину амниотической полости: гипоплазия - амниотическая полость не более 10-12 мм, часто при неразвивающейся беременности, многоводие.
Определение локализации хориона
На 8-ой неделе становится заметна дифференцировка хориона на лысый и ветвистый, в месте формирования плаценты хорион утолщается, отмечается повышение эхогенности. Процесс формирования хориона длительный. Об отношении ветвистого хориона к области внутреннего зева можно судить только тогда, когда плодное яйцо выполняет всю полость матки, т.е.после 9 недель беременности (до этого срока можно говорить только о преимущественной локализации хориона).
Состояние яичников
Кисты желтого тела определяются с ранних сроков как анэхогенное образование округлой формы диаметром не более 40-50 мм, иногда 60-90 мм. В случае исключения других патологических образований назначается контрольное УЗИ после 14-16 недель, так как гормональную функцию берет на себя плацента, и киста подвергается обратному развитию. Отсутствие кисты с ранних сроков может являться неблагоприятным признаком (угроза прерывания беременности вследствие гормональной недостаточности). Этот факт необходимо отражать в протоколе, чтобы клиницист своевременно осуществил дополнительные исследования для определения оптимальной тактики ведения пациентки.
Ультразвуковая анатомия плода/эмбриона
Оценка анатомии развивающегося эмбриона позволяет выявить грубые врожденные пороки развития (ВПР) и ставить вопрос о прерывании беременности в первом триместре, что несомненно является менее травматичным. Для этого необходимы специальные навыки и знания.
Так, дифференцировка эмбриона на головной и тазовый конец происходит на 8 неделе беременности. Головка, как отдельное анатомическое образование визуализируется с 9 недель, определение структур мозга возможно не ранее 12 недель, появляется основной ориентир - срединное М-эхо. С 15-16 недель определяются боковые желудочки мозга, на дне-сосудистые сплетения. С увеличением срока - полушария мозжечка. После 25 недель можно визуализировать мозолистое тело, кора головного мозга, в третьем триместре - извилины головного мозга, с 30 недель - сосуды головного мозга. Визуализация основных отделов желудочковой системы мозга возможна с 23-24 недель. Структуры лица начинают идентифицироваться с 13-14 недель; позвоночник плода с 9-10 недель; конечности - с 9-10 недель, но их идентификация возможна только с 12-14 недель. Оценка передней брюшной стенки для исключения ее дефектов производится после 11 недель (до этого срока - физиологическая эмбриональная грыжа, состоящая из петель кишечника, выбухающих за пределы брюшной полости через пупочное кольцо (эхогенное образование 5-6 мм в области передней брюшной стенки). Сердечная деятельность эмбриона определяется с 7 недель, 4-х камерный срез с 15-16 нед, однако детальное изучение анатомии сердца возможна после 20 недель (24 нед). Желудок плода визуализируется после 14-16 недель беременности. Почки с 15-16 недель, исследование их внутренних структур после 20 недель беременности; надпочечники после 20-22 недель; мочевой пузырь - после 16-18 недель; кишечник плода с конца второго триместра; печень, селезенка, легкие - с середины второго триместра. Трансвагинально все внутренние органы идентифицируются на 3 - 4 нед раньше.
Таким образом, в первом триместре беременности могут быть выявлены лишь грубые ВПР.
Особое внимание необходимо уделять эхографическим маркерам хромосомных аберраций в первом триместре беременности: до 10 недель - размер метэнцефалической полости - не более 5 мм, с 10 до 14 недель -
размер воротникового пространства (в сагитальной плоскости сканирования измеряется анэхогенная зона в шейном отделе позвоночника. Так, при ее величине 3 мм частота ВПР сердца - 3 %, 5 мм - 80 %, 7 мм - 100 %.
Оценка внутреннего зева шейки матки
Размеры шейки матки: длина - 3,5-4,0 см, передне-задний размер на уровне внутреннего зева - 23-26 мм, к 18 недель - 31 мм, ширина цервикального канала на уровне внутреннего зева - 2-3 до 5 мм.
Признаки иствико-цервикальной недостаточности (ИЦН):
укорочение шейки
расширение цервикального канала
увеличение передне-заднего размера шейки матки
Безапеляционно диагноз ИЦН ставится при пролабировании плодного пузыря в шейку матки, в основном диагноз ставит клиницист. Оценку состояния шейки для исключения ИЦН дают не ранее 10 недель
беременности, когда плодное яйцо занимает всю полость матки.
Визуализация стенок матки и придатков
Наличие перегородок в полости матки, амниотических тяжей, миоматозных узлов или других опухолевидных образований, их локализация, размеры, структура, рубцовые деформации, аномалии развития матки. Особенно важным является проведение УЗИ при осложненном течении беременности.
Диагностика патологии беременности в первом триместре
АНЭМБРИОНИЯ ПЛОДА
Устанавливается на основании выявления "пустого" плодного яйца с 8 - 9 - 10 нед. беременности, т.е. отсутствует эмбрион.
АНТЕНАТАЛЬНАЯ ГИБЕЛЬ ПЛОДА/ЭМБРИОНА
Основные критериии:
отсутствие сердечной деятельности,
отсутствие двигательной активности,
несоответствие размеров матки, плодного яйца, эмбриона сроку беременности
УГРОЗА ВЫКИДЫША
УЗ критерии:
локальное утолщение миометрия,
изменение конфигурации плодного яйца,
изменения шейки матки:укорочение длины,увеличение передне-заднего равмера,увеличение диаметра внутреннего зева.
НАЧАВШИЙСЯ АБОРТ
Происходит отслойка плодного яйца, сопровождающаяся кровянистыми выделениями.
УЗ критерии:
локальное утолщение миометрия,
ретрохориальная гематома как анэхогенное образование между стенкой матки и хорионом, но может ее и не быть.
Для клинициста важно дать информацию о состоянии эмбриона: анэмбриония, живой эмбрион, мертвый. Тактика при этом разная: при наличии живого эмбриона проводится терапия, направленная на сохранение беременности.
НЕРАЗВИВАЮЩАЯСЯ БЕРЕМЕННОСТЬ
УЗ критерии:
нечеткие контуры плодного яйца,
деформация плодного яйца,
неоднородная структура содержимого плодного яйца,
эмбрион без признаков жизнедеятельности, в зависимости от давности гибели, либо в неизмененном виде, либо в виде отдельных фрагментов.
ШЕЕЧНО-ПЕРЕШЕЕЧНАЯ БЕРЕМЕННОСТЬ
УЗ критерии:
плодное яйцо визуализируется в шеечно-перешеечной области.
Дифференциальный диагноз следует проводить с абортом в ходу: УЗ картина та же, помогает клиника: боли, кровотечение.
НЕПОЛНЫЙ АБОРТ
УЗ критерии:
расширение полости матки с наличием в ней неоднородного содержимого, стенки полости неровные, нечеткие контуры,
утолщение стенки матки за счет гипертонуса,
наличие гиперэхогенного образования в полости - плацентарный полип.
ПУЗЫРНЫЙ ЗАНОС
УЗ критерии:
несоответствие размеров матки сроку беременности,
полость матки расширена, заполнена неоднородным содержимым, феномен "снежной бури", множественные кистозные образования различной величины и формы,
наличие двухсторонних лютеиновых кист.
ВНЕМАТОЧНАЯ БЕРЕМЕННОСТЬ
УЗ критерии: Зависят от варианта клинического течения: прогрессирующая, прогрессирующая с анэмбрионией, неразвивающаяся, последняя бывает 2х видов: плодное яйцо прекращает развитие и признаков нарушения беременности нет и нарушенная по типу трубного аборта с образованием осумкованной гематомы: по типу разрыва трубы с внутрибрюшным кровотечением.
свободная жидкость в позадиматочном пространстве,
гиперплазия эндометрия,
некоторое увеличение размеров матки,
наличие образования в области придатков гетерогенной эхоструктуры с нечеткими контурами,
при прогрессирующей внематочной беременности: рядом с маткой - плодное яйцо, живой эмбрион или без эмбриона.
МНОГОПЛОДНАЯ БЕРЕМЕННОСТЬ
УЗ критерии:
в полости матки определяется несколько плодных яиц, эмбрионов.
Необходимо повторное исследование, т.к. часто анэмбриония одного из плодных яиц или гибель эмбриона на ранних его стадиях с последующей резорбцией плодного яйца или выкидышем погибшего эмбриона.
Клинический анализ крови
Анализ крови – это достаточно простой и в то же время эффективный способ узнать о состоянии организма беременной.
Как сдавать?
Кровь берут из пальца утром натощак. Накануне вечером не следует употреблять жирную пищу, желательно также воздержаться от стресса.Расшифровка анализа крови у беременных.
Гемоглобин
При беременности допустимая нижняя граница нормы – 110. Если уровень гемоглобина оказывается ниже, у женщины анемия, ребенок не получает достаточного количества питательных веществ и кислорода и может начать отставать в развитии. Поэтому при низком уровне гемоглобина беременной требуется лечение.
Тромбоциты
Снижение уровня тромбоцитов (ниже 180,0) требует дополнительного исследования свертывающей системы крови, так как именно тромбоциты способствуют предотвращению массивного кровотечения во время родов
Лейкоциты
Если их уровень повышен (более 9,0), это может быть признаком инфекции у беременной.
Нормальные значения показателей общеклинического исследования крови у женщин: гемоглобин – 120-140 г/л; эритроциты – (3,9-4,7)х1012/л; цветовой показатель – 0,86-1,1; СОЭ – 2-15 мм/ч; ретикулоциты – 2-10%; тромбоциты – (180-320)х109/л; лейкоциты (4,0-9,0)х109/л – нейтрофилы: миелоциты – 0%, метамиелоциты – 0%, палочко-ядерные – 1-6%, сегментоядерные – 47-72%; эозинофилы – 0,5-5%; базофилы – 0-1%; лимфоциты – 19-37%; моноциты – 3-11%.
Общий анализ мочи
Позволяет оценить выделительную функцию почек и общее состояние организма.
Белок в моче
Наличие белка в моче может быть симптомом осложнения беременности – гестоза (токсикоза второй половины беременности).
Глюкоза
Присутствие глюкозы может указывать на сахарный диабет беременных. При подозрении на это заболевание врач назначит нагрузочные тесты для определения уровня сахара в крови.
Лейкоциты
Повышение количества лейкоцитов (норма – не более 4) и наличие бактерий может быть признаком цистита или пиелонефрита – воспаления мочевого пузыря и почек во время беременности.
Кетоновые тела
Их присутствие может говорить о том, что из-за сильного токсикоза организму не хватает питательных веществ.
Белок в моче при беременности. Протеинурия и беременность
Белка в моче здорового человека быть не должно. При беременности белок в моче женщины в очень небольших количествах считается нормой.
Более 300 мг в сутки белка в моче беременной свидетельствует о неполадках в организме, в частности в мочеполовой системе женщины, о заболевании почек. В период беременности может происходить обострение хронических заболеваний почек, которое сопровождается появлением белка в моче беременной.
В случае выявления протеинурии у беременных (белка в моче) будущей матери необходимо регулярно наблюдаться у врача-гинеколога и уролога, чтобы предупредить возможные осложнения. Если протеинурия у беременной наблюдается продолжительной время или число белка в моче во время беременности резко возрастает, то будущей матери понадобится госпитализация и дальнейшее лечение в стационаре, зачастую врачи вынуждены вызвать преждевременные роды, чтобы спасти жизнь матери и ребенка.
Протеинурия беременных на 32 неделе указывает на развитие нефропатии. При этом протеинурия сопровождается повышением артериального давления. При нефропатии нарушается функция плаценты, которая становится неспособной защищать плод от негативных внешний воздействий, обеспечивать достаточным количеством кислорода и питанием. Все это может привести к преждевременным родам, задержке внутриутробного развития и в самых тяжелых случаях – к гибели плода.
Бактерии в моче при беременности. Бактериурия и беременность.
Бактериурия у беременных – наличие бактерий в моче при беременности – распространенное явление, бактерии в моче беременных женщин встречаются в 5 раз чаще, чем у небеременных. Риск развития пиелонефрита при беременности намного повышается, примерно в 40% случаев пиелонефрит впервые диагностируется у беременных женщин, беременные болеют пиелонефритом в 2 раза чаще, чем мужчины.
Бактерии в мочи при беременности как признак острого пиелонефрита – основная причина преждевременных родов. В моче беременных женщин при этом обычно обнаруживают кишечную палочку (Escherihia coli).
Особо опасное явление при беременности – бессимптомная бактериурия. Беременная женщина может и не замечать нарушения функции почек, однако это не означает, что не страдает малыш. При бактериурии анализ мочи – информативный метод исследования, позволяющий вовремя предупредить опасность для здоровья будущей матери и ее ребенка.
Лейкоциты в моче при беременности (лейкоцитурия беременных)
При беременности лейкоциты в моче – признак пиелонефрита и других инфекционных заболеваний почек. Воспалительные заболевания мочеполовой системы отрицательно влияют на течение беременности, так и на развитие плода. Поэтому вовремя обнаруженные симптомы помогут сохранить здоровье не только Вам, но и Вашему малышу.
Фосфаты в моче при беременности
При беременности мутная моча – означает наличие в ней примеси солей (фосфатов, уратов, оксалатов кальция), бактерий, эритроцитов, лейкоцитов и даже гноя.
В норме во время беременности в моче женщины количество солей резко уменьшается, поскольку значительная часть фосфорно-кислых соединений идет на формирование костей скелета плода, а после родов – на образование молока. Повышение солей в моче беременной женщины – признак неполадок в мочеполовой системе будущей матери.
Анализ мочи: беременность и рН (кислотность мочи)
Кислотность мочи при беременности зависит от характера питания. Если Вы любите мясную пищу – то при анализе мочи будет наблюдаться кислая реакция мочи, если Вы – вегетарианка или придерживаетесь молочной диеты, то реакция мочи будет щелочной.
Понижение нормы рН беременной свидетельствует о выраженном раннем токсикозе, который сопровождается рвотой, поносом, т. е. потерей жидкости организмом. Понижение рН происходит при недостатке калия (К).
При беременности кетоновые тела в моче также свидетельствуют о раннем токсикозе.
Любые изменения в моче беременной женщины обычно сопровождают изменения других показателей. Врачи рассматривают показатели мочи не по отдельности, а комплексно. Помимо перечисленных выше параметров, акушеры-гинекологи и урологи исследуют следующие показатели мочи:
Цвет мочи и прозрачность мочи
Удельный вес мочи
Билирубин в моче
Эритроциты в моче (гематурия)
Эпителий в моче
Цилиндры в моче.
Плохой анализ мочи при беременности служит поводом для дополнительного обследования – повторный общий анализ мочи или другие анализы мочи и крови. Однократно выявленные изменения мочи – это еще не диагноз, его надо или подтвердить, или же опровергнуть, для этого акушером-гинекологом назначается дополнительное обследование, например, анализ мочи по Нечипоренко, бактериологический посев мочи и многие другие.
Как собрать мочу на анализ правильно:
Перед сбором мочи на анализ необходимо провести тщательный туалет половых органов. Для анализа используют среднюю порцию мочи, набранную в чистую посуду. Мочу на анализ необходимо доставить не позднее 2х часов после получения мочи, иначе результаты будут недостоверными. При длительном стоянии многие компоненты мочи начинают разрушаться, к моче примешиваются посторонние бактерии, которые также искажают показатели мочи.
Гинекологический мазок
Анализ отделяемого мочеполовых органов женщины
Лейкоциты
Повышение уровня лейкоцитов (более 15) может свидетельствовать о воспалительном процессе во влагалище (кольпит) или цервикальном канале (цервицит). Необходимо дополнительное бактериологическое обследование.
Гонококки и трихомонады
В норме должны отсутствовать. Если они обнаружены, будущей маме понадобится пройти курс лечения.
ХГЧ (хорионический гонадотропин человека) или ХГ (хорионический гонадотропин) – особый гормон беременности.
Диагностировать беременность можно и с помощью домашних тестов определения беременности, основанных на анализе ХГ, выделяемого c мочой. Но достоверность результата ХГЧ, полученного «домашним» способом, значительно ниже, чем лабораторный анализ крови ХГЧ, поскольку необходимый для диагностики уровень ХГЧ в моче достигается на несколько дней позже, чем в крови
Гормон ХГЧ вырабатывают клетки хориона (оболочки зародыша). На основании анализа крови на b-ХГЧ врач определяет присутствие в организме хориальной ткани, а значит – беременность женщины. Анализ крови ХГЧ делает возможным раннее определение беременности – уже на 6-10 день после оплодотворения результат ХГЧ будет положительным.
Роль ХГ в первом триместре беременности – стимуляция образования необходимых для развития и поддержания беременности гормонов, таких как прогестерон, эстрогены (эстрадиол и свободный эстриол). При нормальном развитии беременности в дальнейшем эти гормоны производит плацента.
Хорионический гонадотропин очень важен. У плода мужского пола ХГЧ стимулирует так называемые клетки Лейдига, которые синтезируют тестостерон. Тестостерон в этом случае просто необходим, так как способствует формированию половых органов по мужскому типу, а также оказывает воздействие на кору надпочечников эмбриона.
.
Мы приведем самые распространенные случаи, когда врач назначает анализ на ХГЧ.
У женщин:
Аменорея
Диагностика беременности на ранних сроках
Исключение возможности внематочной беременности
Для оценки полноты искусственного аборта
ХГЧ сдается и для динамического наблюдения за беременностью
При угрозе выкидыша и на неразвивающуюся беременность
Диагностика опухолей – хорионэпителиомы, пузырного заноса
Наряду с АФП и свободным эстриолом – в качестве пренатальной диагностики пороков плода
У мужчин:
Диагностика опухолей яичек.
Нормы ХГЧ в сыворотке крови
Норма ХГЧ, мЕд/мл
Мужчины и небеременные женщины < 5
Уровень ХГЧ при беременности:
1 – 2 неделя 25 – 300
2 – 3 неделя 1500 – 5000
3 – 4 неделя 10000 – 30000
4 – 5 неделя 20000 – 100000
5 – 6 неделя 50000 – 200000
6 – 7 неделя 50000 – 200000
7 – 8 неделя 20000 – 200000
8 – 9 неделя 20000 – 100000
9 – 10 неделя 20000 – 95000
11 – 12 неделя 20000 – 90000
13 – 14 неделя 15000 – 60000
15 – 25 неделя 10000 – 35000
26 – 37 неделя 10000 – 60000
Расшифровка ХГЧ
В норме при беременности уровень ХГЧ постепенно повышается. Во время 1 триместра беременности уровень b-ХГЧ быстро нарастает, удваиваясь каждые 2-3 дня.
На 10-12 неделе беременности достигается самый высокий ХГЧ-уровень в крови, затем содержание ХГЧ начинает медленно понижаться и остается постоянной в течение второй половины беременности.
Повышение бетта-ХГЧ при беременности может происходить при:
многоплодии (норма ХГЧ увеличивается пропорционально числу плодов)
токсикозе, гестозе
сахарном диабете матери
патологиях плода, синдроме Дауна, множественных пороках развития
неправильно установленном сроке беременности
приеме синтетических гестагенов
Повышение ХГЧ может быть признаком серьезных заболеваний у небеременных женщин и у мужчин:
опухоли яичек
опухолевые заболевания желудочно-кишечного тракта
новообразования легких, почек, матки
пузырный занос, рецидив пузырного заноса
хорионкарцинома
прием препаратов ХГЧ
анализ на ХГЧ был сделан в течение 4-5 дней после аборта и.т.д.
Обычно ХГЧ повышен, если тест ХГЧ был произведен на 4-5 день после аборта или вследствие приема препаратов ХГЧ. Высокий уровень ХГЧ после миниаборта указывает на продолжающуюся беременность.
Низкий ХГЧ у беременных женщин может означать неправильную постановку срока беременности или быть признаком серьезных нарушений:
внематочная беременность
неразвивающаяся беременность
задержка в развитии плода
угроза самопроизвольного аборта (пониженный ХГЧ более чем на 50%)
хроническая плацентарная недостаточность
истинное перенашивание беременности
гибель плода (во II-III триместре беременности).
Случается, что результаты анализа ХГЧ показывают отсутствие гормона в крови. Такой результат может быть, если тест ХГЧ был проведен слишком рано или при внематочной беременности.
Какой бы результат анализа на гормоны при беременности не получился, помните, что верную расшифровку ХГЧ может дать только квалифицированный врач, определяя какой ХГЧ норма именно для Вас в комплексе с данными, полученными другими методами обследования.
Как правильно сдать анализ крови на гормон ХГЧ
Как правильно подготовиться к анализу и когда его сдавать, вам должен сказать ваш доктор. Мы дадим лишь самые общие рекомендации, если вы не получили их у своего гинеколога.
Для выполнения анализа ХГЧ берут кровь из вены. Кровь на ХГЧ рекомендуется сдавать в утренние часы и строго натощак. Если вы сдаете тест на ХГЧ в другое время, необходимо воздерживаться от еды в течение 4-6 часов. И вы должны сообщить медсестре или своему врачу, если принимаете какие-либо гормональные препараты.
Лабораторный тест определения беременности в ранние сроки рекомендуется проводить не ранее 3-5 дней задержки менструации. Анализ крови на беременность можно повторить через 2-3 дня для уточнения результатов. Анализ крови на бета-ХГЧ в нашем медицинском центре также может быть выполнен срочно.В комплексной диагностике беременности на ранних сроках наряду с анализом на ХГ необходимо сделать УЗИ влагалищным датчиком. Для выявления патологии плода у беременных анализ на ХГ, хорионический гонадотропин, сдается с 14 по 18 неделю беременности.
С чего начинается беременность для будущей мамы? С первого УЗИ, подтвердившего наличие беременности. Не только потому, что лучше раз увидеть, чем сто раз услышать от участкового врача и не лишь затем, чтобы украсить семейный альбом изображением плодного яйца в полости матки (хотя и в этом благе цивилизации на сегодняшний день отказать себе трудно!) Есть ещё множество причин, которые обязывают нас - врачей и пациенток - к ультразвуковому исследованию при задержке менструации и начальных симптомах беременности раннего срока (БРС). Основные из них таковы:
1. необходимо точно знать, что беременность - маточная;
2. необходимо исключить пузырный занос (опасное заболевание, при котором отмечаются все клинические и лабораторные признаки беременности);
3. при подтверждении беременности необходимо уточнить качество гестационного процесса, при патологическом течении беременности - своевременно выявить сущность проблемы для раннего начала лечения;
4. УЗИ поможет уточнить срок беременности - эта информация будет полезна до самых родов;
5. и, наконец, если есть задержка менструации, но беременность не обнаружена, УЗИ поможет выявить возможное гинекологическое заболевание или функциональное состояние, симптомом которого явилась задержка месячных или изменение самочувствия.
Критики применения ультразвуковой диагностики при БРС не располагают столь убедительными доводами в защиту своей позиции. С полезностью проведения УЗИ БРС мы разобрались выше, а положение о возможном вреде, якобы причиняемым ультразвуком живым тканям, в достаточной мере опровергнут многочисленными экспериментами на зародышах животных и клиническими наблюдениями. Безопасность медицинского ультразвука доказана и отражена в международных документах. Хотя в литературе можно встретить рекомендации по сокращению продолжительности каждого исследования БРС до минимально возможных пределов, эти рекомендации носят скорее этический характер, отдающий дань настороженному отношению некоторых пациенток к УЗИ БРС.
Что может ультразвук при БРС и чего не может?
Регистрация наличия маточной беременности при помощи современного УЗ-сканера, оснащённого трансвагинальным трансдьюссером (датчиком) возможна в сроке 2,5-3 недели от зачатия, что соответствует задержке месячных в 3-5 дней. Кстати говоря, для обозначения срока беременности при УЗИ БРС принято пользоваться так называемым эмбриологическим сроком беременности, то есть счётом времени, прошедшим от предполагаемого слияния половых клеток. Между тем как в "большом" акушерстве отсчёт срока беременности принято вести от первого дня последней менструации, что иногда является источником путаницы. Для "конвертации" эмбриологического гестационного возраста в акушерский срок беременности достаточно прибавить к первому 2-2,5 недели.
Таким образом, именно в сроке 2,5-3 н.б. бластоциста, завершив процесс имплантации в слизистую оболочку одной из стенок матки, становится доступной для исследования. С этого момента она называется плодным яйцом (более правильное название - эмбриональная камера) и выглядит как эхонегативное (т.е. не отражающее ультразвуковых волн, на экране - предельно тёмное) округлое или каплевидное образование, окруженное тонкой оболочкой, 4-5 мм в диаметре. Плодное яйцо выглядит как однородная жидкость, эмбрион и внезародышевые органы имеют ещё микроскопическое строение, локализованы пристеночно и не видны при помощи ультразвука. Плодное яйцо чаще всего прикреплено в области одного из трубных углов матки (чаще-правого). Встречаются и другие локализации плодного яйца, например, проксимальное положение ("низкое", ближе к перешейку). Это не является патологическим признаком и не говорит о плохом прогнозе беременности. Так бывает тогда, когда бластоциста имплантировалась в матку не сразу по выходе из маточной трубы, а перемещалась в полости матки ещё в течение нескольких дней.
Что делать, если есть задержка менструации и другие признаки беременности, а при УЗИ в матке не обнаружено плодного яйца? Необходимо повторить исследование через одну-две недели для того, чтобы искомое плодное яйцо увеличилось в размерах достаточно для беспроблемной визуализации (видения, различения). Если повторное исследование не принесло результата - нужно дальнейшее обследование, целью которого будет исключение возможной внематочной беременности. При помощи одного лишь УЗИ установить диагноз внематочной беременности, к сожалению, невозможно, но заподозрить - можно.
Иногда повторное исследование бывает необходимо тогда, когда в полости матки выявляется округлое жидкостное образование, но есть лабораторные и клинические данные, позволяющие усомниться в наличии беременности. Округлое жидкостное образование может оказаться железистым полипом, наботовой кистой и даже небольшим миоматозным узелком, выдающимся в полость матки. Именно поэтому УЗИ БРС (как, впрочем, и любого другого срока) лучше проходить в учреждении, специализирующемся на работе с беременными - ЖК, родильном доме, перинатальном центре - где врач-эхоскопист обладает знаниями по физиологии и патологии женской половой сферы, акушерству и прикладной эмбриологии. Учреждения, оказывающие услуги по типу "УЗИ всего и вся" обречены на большую долю диагностических неудач в своей работе.
Но вот все позади и плодное яйцо в полости матки растёт не по дням, а по часам. К четырём неделям беремености средний диаметр плодого яйца достигает 17-20 мм. Плодное яйцо меняет конфигурацию, принимая форму полости матки и уже не круглое, а овальное. Размеры матки при этом незначительно увеличиваются, часто проявляется ассиметрия стенок матки - одна стенка становится толще другой. Эмбрион по-прежнему не визуализируется, но хорошо заметен желточный мешок - временное образование, хранящее запас питательных веществ для эмбриона, который сам ещё не виден, а появится на экране в виде отдельного образования только лишь в 5 недель берменности. Эмбрион на 5-недельном сроке различим в виде продолговатого объекта длиной в несколько мм, к внутренней поверхности плодного яйца идёт амниотическая ножка - будущая пуповина. Именно благодаря ей эмбриончик меняет пристеночное расположение на "свободное плавание" в жидкости эмбриональной камеры. Кстати, эмбриончик или два? Или больше? Вопрос, мягко говоря, волнующий, но при 5-недельной беременности уже вполне разрешимый. Двойни бывают разными и определяющим признаком в дифференцировке вида двоен является количество и строение амниотических оболочек и хориона - будущей плаценты.
Если к слизистой оболочке матки прикрепляется бластоциста, несущая в себе два эмбриона (причины дополнительного удвоения зародышевого материала ещё не до конца выяснены) - формируется монохориальная ("однояйцевая") двойня. Для детей из такой двойни характерен феномен близнецовости - полной идентичности хромосомного набора. Детишки из м-двойни всегда однополые и похожи друг на друга, как две капли воды.
Если перед зачатием овулирует не один фоликул, а два (чаще - в разных яичниках) - происходит слияние не одной, а двух пар половых клеток с формированием двух бластоцист, которые в процессе имплантации формируют два плодных яйца с двумя эмбрионами. Такая двойня называется бихориальной или дихориальной ("разнояйцевой") двойней. Дети, родившиеся от беременности би-двойней - не близнецы. Такой вариант формирования двойни - преимущественный: бихориальными являются около 70% двоен.
Каков же механизм формирования троен и других многоплодных беременностей? Самый различный. Количество амниотических оболочек и хорионов может варьировать самым причудливым образом. Напримет, тройня может состоять из двух эмбриончиков-близнецов и одного не-близнеца, также воможны любые другие варианты. Кстати говоря, именно при УЗИ БРС открываются широкие возможности дифференциации типа двойни. На больших сроках беременности, когда эмбриональные камеры выполнят всю полость матки и будут располагаться компактно, решение этой диагностической задачи будет сопряжено уже с более значительными трудностями.
Есть ещё один важный момент. Двойни, о которых мы говорили раньше, были би(ди)амниотическими - то есть каждый эмбрион находился в собственной эмбриональной камере. Возможен (хотя, по счастью, довольно редок) другой вариант - монамниотическая монохориальная двойня, когда два эмбриона не разделены межамниотической перегородкой. Это заведомо патологический вариант течения гестационного процесса. Такие эмбриончики очень часто бывают генетически неполноценными, кроме того, близкое их интимное соседство открывает широкие возможности для формирования сросшейся двойни ("сиамских близнецов"). Такая беременность безусловно подлежит прерыванию на возможно раннем сроке. Стоит ли говорить, что именно возможностям медицинской эхоскопии человечество обязано предотвращением многих человеческих катастроф подобного рода.
Би-двойни имеют ещё одну отличительную особенность: раз такая двойня является следствием овуляции двух фолликулов, стало быть, в яичниках исследователь найдёт не одно, а два желтых тела. Что же такое желтое тело?
ЖТ - это провизорный (временный) гормональный орган, возникающий в яичнике на месте овулировавшего фолликула. При УЗИ он виден в качестве небольшого неоднородного округлого мягкотканного образования. ЖТ является источником важнейшего гормона беременности - прогестерона. Попытки применить описательные характеристики УЗ-изображения ЖТ для диагностики прогестероновой недостаточности не оправдали себя. Для диагностики этой недостаточности есть иные признаки - клинические, лабораторные и ультразвуковые - нежели "недостаточные размеры" ЖТ или "отсутствие ЖТ" (последнее, кстати говоря, возможно только при непорочном зачатии).
Неисякаемым источником сомнений и недоумений врачей и пациенток являются кисты желтого тела. Желтое тело постоянно вырабатывает небольшие количества жидкости, которые частично (или полностью) резорбируются мелкими кровеносными сосудами яичника, а частично остаются внутри яичника с формированием кисты (от греческого корня "cyst" - "пузырёк"). Киста ЖТ никогда не достигает больших размеров и полностью рассасывается к 10-15 неделе беременности, синхронно с регрессом самого желтого тела. Наличие кисты ЖТ не является признаком осложнённого течения беременности и ни лечения, ни даже динамического наблюдения. Иногда при наличии такой кисты будущая мама может испытывать нерезкие боли в низу живота, которые иногда ошибочно принимают за симптом угрожающего выкидыша ("угрозы").
Как же быть в этом случае и бывают ли истинные ультразвуковые признаки угрожающего выкидыша? Бывают, но сначала определимся с тем, что такое выкидыш и как он происходит. Выкидыш можно в упрощённом виде представить как сокращения миометрия (мышцы матки), вызывающие ослоение плодного яйца от внутренней стенки матки и изгнание его из полости матки. Соответственно фазе этого процесса, самопроизвольный выкидыш бывает угрожающим, начавшимся, "в ходу" и свершившимся. Нетрудно догадаться, что УЗ-признаком угрожающего аборта прежде всего будут признаки избыточного напряжения (гипертонуса или просто "тонуса") маточного мускула. Признаки эти следующие: • утолщение одной из стенок матки (чаще - передней). Причины утолщения понять несложно - вспомним, например, как выглядит напряженный бицепс в сравнении с расслабленным. Этот УЗ-признак достаточно обманчив - о физиологической ассиметрии маточных стенок при БРС мы уже говорили выше. Кроме того, давление вагинального датчика на область перешейка матки может спровоцировать непродолжительное и безобидное сокращение матки, которое может быть интерпретировано как признак угрожающего выкидыша. Для того, чтобы отличить зону длительного гипертонуса от кратковременного маточного сокращения, можно продолжить исследование при помощи трансабдоминального ("обычного") датчика с пустым мочевым пузырём. Кратковременный тонус скоро исчезнет, чего нельзя сказать о длительно существующем застойном гипертонусе.
• утолщенный миометрий меняет конфигурацию плодного яйца, делая её ладьевидной или каплеобразной, иногда изменяется и наружный контур матки (сократившийся участок миометрия возвышается над ровным контуром матки)
• наиболее неблагоприятный признак угрожающего и начавшегося выкидыша - обнаружение в полости матки рядом с плодным яйцом небольшого количества излившейся крови - субхориальная гематома (гравидарная гематометра). Источник этой крови - мелкие сосуды, разрушенные самим же плодным яйцом при инвазии в стенку матки. Опасность состоит в том, что гематома, увеличиваясь в размерах, может оказать давление на плодное яйцо и спровоцировать утерю связи меж ним и стенкой матки. При помощи УЗИ можно оценить локализацию и объем гравидарной гематометры, давность процесса и наличие тенденции к прогрессированию. Таким образом, ультразвук незаменим для уточнения причин болей и кровянистых выделений при беременности и в распознавании типа угрожающего выкидыша (лечебная тактика при гипертонусе матки с гематомой и без нее будет разной и даже взаимоисключающей). Хотя абсолютизация ультразвуковых данных тоже не пойдёт на пользу пациенткам и сведения о "гипертонусе матки" при отсутствии болей в низу живота, кровянистых выделений и других признаков угрожающего выкидыша нужно истолковать как чисто аппаратный феномен. В распространившемся жаргонизме: "угроза по УЗИ" содержится не более смысла, чем, например, во фразе: "головная боль по анализу мочи".
А бывает самопрозвольный выкидыш без болей и гипертонуса? К сожалению, бывает. Речь в этом случае идёт о несостоявшемся выкидыше (более известном под названиями "анэмбриония", "неразвивающаяся" или "замершая беременность"). Речь в этих случаях идёт о прекращении жизнедеятельности эмбриона при отсутствии сократительной деятельности матки, которая могла бы быть направлена на изгнание нежизнеспособного плодного яйца из её полости.
При анэмбрионии при УЗИ на 5 н.б. не удается визуализировать эмбриона или всех элементов эмбрионального комплекса. Это, безусловно, не означает, что плодное яйцо исходно было "пустым", просто развитие зародыша прекратилось до того, как эмбрион достиг размеров в 1-2 мм. Чтобы преодолеть возможность диагностической ошибки в определении анэмбрионии, иногда бывает нужно назначить повторное исследование с интервалом в неделю, дабы увеличившийся в размерах эмбрион был отчётливо виден (например, при короткой амниотической ножке и пристеночном расположении эмбриона). При истинной анэибрионии плодное яйцо может расти (что объясняется накоплением жидкости в нём), но изображения эмбриона получить по-прежнему не удастся.
Особый случай анэмбрионии - анэмбриония одного из плодных яиц при двойне. Такая ситуация называется биамниотической монэмбриональной беременностью или несостоявшейся двойней. В этом случае описанная выше катастрофа постигает один из эмбрионов, другой же развивается нормально. "Пустая" амниотическая полость визуализируется рядом с нормальной, затем, по мере роста плодного яйца, серповидно огибает изображение нормальной амниотической полости до тех пор, пока не сливается полностью с нею. Иногда признаки несостоявшейся двойни сохраняются длительно и описываются как "двойной контур плодного яйца" или "амниотическая нить в полости матки". Эти УЗ-феномены не тягощают течения прогрессирующей одноплодной беременности.
Замершая беременность - это несостоявшаяся выкидыш в сроке 5 и более недель. Отличие от анэмбрионии состоит лишь в том, что эмбриональный комплекс виден, но виден как несколько слабодифференцируемых линейных объектов, лишённых признаков жизнедеятельности - сердцебиения и двигательной активности, присущих нормальному эмбриончику при прогрессирующей беременности.
Нормальный же эмбриончик достигает размеров 7-8 мм при 5-недельной беременности, 12-13 мм - при 6-недельной и 18-19 мм - при 7 недельной беременности. "Рост" эмбриона называется копчико-томенным размером (КТР). Параллельно нарастает и "окружность талии" эмбриончика - от 2-3 мм до 6-8 за описанный промежуток времени. Начиная от 5 недели определяется "пульсация эмбриона" - видны сердечные сокращения, но ещё невозможно различить на экране самого сердца. Частота этих сокращений от 120-130 уд/мин на 5-6 н.б. до 200 уд/мин к 7-8 н.б. Иногда при УЗИ удаётся наблюдать разгибательные движения эмбриона.
К 5 неделе от зачатия удаётся отличить головной конец от тазового, к 6 неделе заметны бугорки на месте будущих конечностей. Внутренние органы будущего плода ещё формируются и будут видны после 8 н.б., к концу 7 недели видны формирующийся позвоночник и кости черепа. Эмбриончик бодр, очень фотогеничен, полон сил и ждёт следующей встречи с мамой, которая состоится в кабинете УЗ-диагностики в сроке 10-14 акушерских недель (то есть 8-12 нед от зачатия). Об этой встрече мы тоже подробно расскажем. Впереди эмбриончик поджидает ещё много опасностей, но при помощи мамы, врача и, конечно, медицинского ультразвука он благополучно минует все напасти, скоро получит повышение - станет уже не эмбрионом, а Плодом, а вскоре - и новорожденным. Так что - до следующей встречи в кабинете УЗД!
Источник http://pospelow.narod.ru/uzi-brs.htm

Здравствуйте.
Я сама пережила это состояние и прошла множество врачей, которые не знали, чем мне помочь.
Эту
УЗИ при беременности раннего срока

...поместил Я его [человека] каплей в утробе матери,
потом создал из капли сгусток крови,
и создал из сгустка крови кусок мяса,
создал из этого куска кости и облек кости мясом,
потом Я превратил его в другое творение,
- благословен Бог, лучший из творцов!
Коран, Сура 23, стих 12-14
Выкидыш: причины, признаки, диагностика, очищение и восстановление после
Девочки нашла тут статью, хочу поделиться. Если б в свое время я была бы более внимательной к таким вещами (не говорю о врачах) ЭТОГО можно было бы избежать Тромботические осложнения являются наиболее серьезными, потенциально смертельными осложнениями вспомогательных репродуктивных технологий. Частота использования искусственных репродуктивных технологий продолжает активно увеличивает, так в 2004 году в Европе эти методики были применены более чем у 250 000 женщин [1]. У женщин, включаемых в программы ЭКО, имеет место объективно более высокий риск венозных тромбоэмболических осложнений (ВТЭ). Это связано с их более старшим возрастом, высокой распространенность метаболического синдрома и сопутствующей патологии. Нельзя также не учитывать четкую взаимосвязь между бесплодием и тромбофилическими состояниями, как генетически обусловленными, так и приобретенными, включая антифосфолипидный синдром (АФС). Несмотря на то, что частота ВТЭ у этой группы пациенток согласно мировым данным невысока (0,08-0,11%) [2], учитывая тяжелые осложнения ВТЭ, в том числе и фатальные, а также повышенный риск ВТЭ у пациенток, включаемых в программы ЭКО, этот вопрос требует особого внимания.
Изменения гемостаза, связанные со стимуляцией овуляции
Стимуляция овуляция приводит к возникновению состояния гиперэстрогении. При этом, как и в случае применения оральных контрацептивов и препаратов заместительной гормональной терапии, в результате воздействия экзогенных эстрогенов формируется состояние гиперкоагуляции. Исследования, посвященные изучению влияния сверхфизиологических уровней эстрогенов на систему гемостаза, очень ограничены. Кроме того, интерпретация их результатов осложняется использованием различных протоколов стимуляции овуляции, а также тем, что в эти исследование было включено очень небольшое количество пациенток. В целом результаты этих исследований свидетельствуют о том, что уровни эстрадиола коррелируют с концентрацией фибриногена, уровнями D-димера и резистентностью к АРС [3]. Кроме того, стимуляция овуляции также ассоциируется с увеличением уровней некоторых факторов свертывания крови: фактора V, фибриногена, фактора Фон Виллебранда. Одновременно выявляется повышение маркеров активации система гемостаза - фрагментов протромбина F 1+2 и D-димера и нарушение функций эндогенной антикоагулянтной системы, что проявляется снижением уровней антитромбина и протеина S. Резистентность к АРС увеличивает при стимуляции овуляции и сохраняется на повышенном уровне при проведении поддержки лютеиновой фазы. Важно отметить, что нарушение функции естественных антикоагулянтов и развитие резистентности к АРС представляет особый риск у пациенток с мутацией FV Leiden и антифосфолипидным синдром, когда уже исходно имеющаяся резистентность к АРС определяется фоновое повышение риска тромбоэмболических осложнений.
В еще большей степени эти изменения гемостаза развиваются при синдроме гиперстимуляции яичников (СГЯ). СГЯ сопровождается повышением уровней фибриногена, D-димера, комплексов тромбин-антитромбин и F1+2, снижением уровня прекалликреина и тканевого фактора [4], причем эти изменения сохраняются в течение нескольких недель. Интересно, что повышенные уровни D-димера и комплексов тромбин-антитромбин ассоциируется с неудачами ЭКО [3]. Подобная взаимосвязь между избыточной активацией коагуляции и неудачными результатами ЭКО еще раз подтверждает важность механизмов гемостаза в процессе имплантации. В отличие от нормальных циклов стимуляции овуляции, когда наблюдаются минимальные изменения гематокрита, при СГЯ имеет место выраженная гемоконцентрация, что многократно повышает риск ВТЭ.
Следует обратить внимание на то, что клиническая картина ВТЭ при стимуляции овуляции редко развивается до введения хорионического гонадотропина (ЧХГ). Это наблюдение поставило перед учеными вопрос о роли ЧХГ для активации системы гемостаза. Было показано, что после назначения ЧХГ происходит повышение уровней фибриногена, факторов II, V, VII, VIII и IX. Вслед за такой активацией прокоагулянтных механизмов с задержкой на 2 дня запускаются фибринолитические механизмы, пик активности которых достигает через 8 дней [4]. Кроме того, при использовании очищенного ФСГ мочевого происхождения, которые также содержат ЧХГ, наблюдается снижение уровней протеина С и антитромбина, в то время как для рекомбинантного ФСГ эти изменения не были статистически достоверными по сравнению с женщинами с нормальным менструальным циклом [5]. Таким образом, гиперкоагуляция, связанная с гиперэстрогенией, имеющая место во время стимуляции овуляции, может усиливаться под действием ЧХГ, что имеет место и во время физиологической беременности.
В большинстве случаев для развития тромбоза требуется «синнергичный» эффект нескольких факторов риска (табл. 1).
Таблица 1.
Патогенез тромботических осложнений в условиях стимуляции овуляции и СГЯ
| Гемоконцентрация
Сдавление тазовых вен Состояние гиперкоагуляции Тромбофилические состояния Личный или семейный анамнез тромботических осложнений Нарушение реактивности сосудов |
Риск тромбоэмболических осложнений при использовании вспомогательных репродуктивных технологий
Несмотря на описанные выше выраженные изменения гемостаза, которые возникают при использовании вспомогательных репродуктивных технологий, общая частота ВТЭ в абсолютных значениях остается не высокой. В целом риск ВТЭ у женщин, включенных в программы ЭКО, в 10 раз превышает риск ВТЭ у женщин репродуктивного возраста, который составляет 2-3 на 10 000 человек в год. В то же время при наличии СГЯ тромбоэмболические осложнения развиваются у одной из 128 женщин, таким образом, риск ВТЭ по сравнению с общей популяцией возрастает в 20-40 раз [6]. Согласно недавнему обзору Nelson S.M. и соавт. (2008), при литературном поиске авторам удалось идентифицировать 109 описанных случаев тромбоэмболических осложнений, связанных с использованием вспомогательных репродуктивных технологий [1]. В 70% имели место венозные тромбоэмболические осложнения. Интересно, что в отличие от наиболее часто развивающихся во время беременности илиофеморальных тромбозов, у этих пациентов преобладали тромбозы глубоких вен верхних конечностей, включая тромбозы подключичной и внутренней яремной вены. В качестве одного из возможных патофизиологических механизмов этого явления считают особенности дренирования перитонеальной жидкости, содержащей высокие уровни эстрогенов, в грудной лимфатический проток. В этом случае, вероятно, роль играет сочетание нескольких факторов: анатомических особенностей, состояния гиперкоагуляции, обусловленного экзогенными факторами, и наличие тромбофилий. В 30% случаев тромбозы развиваются у женщин, у которых беременность не наступила. Более того, время до развития тромбоза оказалось больше, чем было принято считать ранее. В среднем тромбоэмболические осложнения развиваются через 40 дней после переноса эмбриона и через 27 дней после индукции овуляции [2]. Описаны случаи тромбозов на фоне стимуляции овуляции в лютеиновую фазу, а также отсроченные тромботические осложнения через 6-7 недель после овуляции. У женщин с СГЯ тромбоэмболические осложнения развивались от нескольких дней до нескольких недель после разрешения симптомов. Более того, описан случай тромбоза после ЭКО на 20-й неделе беременности. Все это свидетельствует о длительной персистенции генерализованных изменений в системе гемостаза в сторону гиперкоагуляции на фоне стимуляции овуляции, о чем нужно всегда помнить при выработке тактики профилактики тромбозов у женщин, вступающих в программу ЭКО.
Артериальные тромбозы у пациенток, включенные в программы ЭКО, развиваются реже, чем венозные, и в более короткие сроки: в среднем через 10-14 дней после переноса эмбриона.
Роль тромбофилии в патогенезе тромботических осложнений программ вспомогательных репродуктивных технологий
Важно помнить о том, что тромбоэмболические осложнения могут развиваться и при отсутствии тяжелого СГЯ, сопровождающегося гемоконцентрацией. По данным Delvigne А. и соавт. (2004), у пациенток с тромбозами в 12% имел место СГЯ средней тяжести и примерно у такого же процента пациенток - СГЯ легкой степени [7]. Кроме того, тяжелые формы СГЯ выявляются у 0,56-6,5% женщин с СГЯ, тогда как тромботические осложнения развиваются у 1 из 128 женщин с СГЯ. Таким образом, для развития тромбозов значение могут иметь и другие фоновые факторы риска тромботических осложнений, в частности, наследственная и приобретенная тромбофилия. Наследственная тромбофилия была выявлена у 23% женщин с СГЯ, причем в 18% обнаружена мутация FVLeiden [8]. Dulitzkyи соавт. (2002) провели проспективную оценку маркеров тромбофилии, включая плазменные уровни антитромбина III, протеина S, протеина С, антифосфолипидных антител, мутацию FVLeiden и MTHFRC677T, у пациенток, госпитализированных в связи с тяжелым СГЯ. При этом один или более маркеров тромбофилии были положительными у 85% женщин. В контрольной группе ни в одном случае не было обнаружено более одного маркера тромбофилии, а частота выявления одного маркера составила 27% [9]. Кроме того, описаны случаи тромботических осложнений на фоне стимуляции овуляции у пациенток с отягощенным семейным анамнезом по тромбозам, при этом известные тромбофилии выявлены не были. Это может свидетельствовать о роли еще не изученных наследственных нарушений в системе гемостаза в патогенезе тромбозов, связанных с использованием вспомогательных репродуктивных технологий. В связи с этим при планировании стимуляции овуляции и стратегий профилактики тромботических осложнений особое внимание необходимо уделять оценке личного и семейного тромботического анамнеза.
Оценка факторов риска тромботических осложнений перед использованием вспомогательных репродуктивных технологий
Перед включением пациенток в программы вспомогательных репродуктивных технологий необходима индивидуальная оценка факторов риска, включая наличие тромбофилических состояний, отягощенного семейного и личного тромботического анамнеза, индекса массы тела, сопутствующих заболеваний, возраста (> 40 лет). Важно отметить, что многократные неудачи ЭКО ассоциируются с высокой частотой тромбофилий, таким образом, эти пациентки относятся к группе повышенного риска по развитию тромбоэмболических осложнений. Так, высокая частота мутаций FV Leiden, протромбина G20210А, MTHFR C677T была с более высокой частотой выявлена у женщин с тремя и более неудачами ЭКО по сравнению с женщинами, забеременевшими с первой попытки, или женщинами, у которых беременность наступила спонтанно [10]. Таким образом, пациенты из этой группы могут быть подвержены значительно более высокому риску развития тромбоэмболических осложнений. У таких женщин мы настоятельно рекомендуем проводить обследование на наличие наследственных и приобретенных форм гемостаза. Это позволяет нам уже на этапе фертильных циклов начать патогенетически обоснованную профилактику с применением низкомолекулярного гепарина, обеспечивающую создание оптимальных условий для имплантации и профилактику тромботических осложнений. Особое внимание следует обратить на высокую частоту антифосфолипидного синдрома у пациенток, включенных в программы вспомогательных репродуктивных технологий, которая составляет 10-48% по сравнению с 1-5% в общей популяции [1]. У таких пациенток повышен риск неудач ЭКО, нарушений имплантации и тромбоэмболических осложнений. Наличие генетических форм тромбофилий, особенно их сочетание с антифосфолипидным синдромом, однонаправленность действия различных форм тромбофилии могут быть причиной клинически не диагностированных ранних преэмбрионических потерь. Антифосфолипидные антитела повышают экспрессию ингибитора активатора плазминогена 1 (PAI-1) и тканевого фактора, что усиливает протромботические механизмы и снижает активность фибринолиза, приводя к дефектам имплантации и снижению глубины децидуальной инвазии трофобласта.
Если считать тромбофилию постоянно персистирующим фактором у женщин с генетической тромбофилией или АФС, то первые ее эффекты представляются как дефекты имплантации плодного яйца, недостаточная глубина инвазии трофобласта, неполноценная плацентация и, как следствие, эндотелиопатия. Предполагается возможная этиологическая роль АФА в генезе бесплодия и привычного выкидыша, препятствующих развитию цитотрофобласта в синцитиотрофобласт на ранних сроках беременности. С нашей точки зрения, новая эра в понимании этиологии и патогенеза бесплодия и неудач ЭКО (в том числе преэмбрионических потерь беременности - после ЭКО) началась с открытия новых наиболее часто встречающихся в общей популяции генетических дефектов гемостаза тромбофилического характера и АФС, а также с установления роли тромбофилии в патологии процессов имплантации плодного яйца, плацентации и более поздних нарушениях маточно-плацентарной перфузии. В процессе подготовки к имплантации под влиянием прогестерона в эндометрии происходит повышение содержания PAI-1, тканевого фактора и снижение уровня активаторов плазминогена тканевого и урокиназного типов, металлопротеаз матрикса и вазоконстриктора - эндотелина 1. Эти физиологические механизмы регуляции гемостаза, фибринолиза, экстрацеллюлярного матрикса и сосудистого тонуса направлены на предотвращение образования геморрагии при дальнейшей инвазии трофобласта. Со своей стороны бластоциста синтезирует активаторы плазминогена тканевого и урокиназного типов и протеазы, которые необходимы для разрушения экстрацеллюлярного матрикса в процессе имплантации. Их излишний синтез в свою очередь регулируется хорионическим гонадотропином. В процессе «дозированного» разрушения матрикса под действием ферментов, выделяемых бластоцистой, клетки эндометрия, которые содержат определенное количество экстраваскулярного фибрина, не фагоцитируются, а как бы «отодвигаются» посредством «контактного ингибирования». Эта фаза процесса имплантации носит название «аваскулярной», или «гистиотрофной». Следует отметить, что это наиболее уязвимая фаза имплантации: часто такие факторы, как вирусы, токсины, антитела и пр., могут непосредственно влиять на полноценность имплантации. С точки зрения влияния тромбофилии наиболее ярким примером являются полиморфизм-1 и другие генетически обусловленные дефекты фибринолиза с повышением уровня PAI-1, гиперфибриногенемией и АФА. Так, согласно нашим данным, тромбофилия как сложный интегральный (с нашей точки зрения, и инициальный) фактор неудачи ЭКО была обнаружена у 90% пациенток с неудачами ЭКО в анамнезе [11]. Таким образом, подготовка к ЭКО женщин с бесплодием и тромбофилией требует особого похода.
В большинстве случаев возникновение тромбозов связано с синдромом гиперстимуляции яичников (СГЯ), поэтому этому серьезному осложнению мы решили посвятить отдельный раздел.
Синдром гиперстимуляции яичников
СГЯ является жизнеугрожающим состоянием, симптомы которого колеблются от легкого недомогания до развития ОРДС, почечной недостаточности и тромбозов. При ЭКО СГЯ развивается у 1-10% женщин. Тромбоэмболические осложнения при СГЯ развивается в 0,04% случаев [12].
Факторами риска развития СГЯ являются молодой возраст пациентки, низкий вес, наличие синдрома поликистозных яичников. Считается, что у женщин молодого возраста плотность рецепторов гонадотропинов больше, следовательно, больше и чувствительность к ним. У пациентов к СГЯ с достоверно большей частотой выявляются атопии по сравнению с контрольной группы [13]. Возможно, нарушение иммунологических механизмов приводит к развитию гиперчувствительности и воспалительного ответа даже в ответ на неспецифические стимуляторы. Риск развития СГЯ во многом определяется видом программы ЭКО. Риск СГЯ больше при применении агонистов гонадолиберин-рилизинг гормона, чем при применении его антагонистов [14]. Еще меньше риск развития СГЯ при применении кломифена цитрата или менопаузального хорионического гонадотропина. Факторами риска СГЯ также является стремительное увеличение уровня эстрадиола в плазме крови (>2500 пг/мл), появление множества фолликулов среднего размера по данным ультразвукового исследования. Кроме того, если в результате ЭКО наступает беременность, начинается дополнительная выработка эндогенного ХГЧ, что увеличивает риск развития СГЯ. Факторы риска развития СГЯ суммированы в табл. 2.
Таблица 2.
Факторы риска развития СГЯ
| Характеристика пациентки:
Молодой возраст (<30 лет) Низкая масса тела СГЯ в анамнезе Сидром поликистозных яичников Использование высоких доз гонадотропинов для стимуляции овуляции Применение ХГЧ, а не прогестерона для поддержки лютеиновой фазы Большое количество антральных в яичнике, по данным УЗИ, до начала стимуляции овуляции Быстрый рост концентрации эстрадиола (>2500 пг/мл) Большое число полученных ооцитов (>20) Наступление беременности |
Описаны семейные случаи СГЯ, в том числе и рецидивов этого синдрома и его развитие во время беременности у родственников. Это может свидетельствовать о наличии наследственных признаков, определяющих повышенный риск развития этого синдрома. Так, сообщается об обнаружении у пациенток с СГЯ полиморфизма рецепторов ФСГ, которые определяют повышенную чувствительность рецепторов к этому гормону [12].
Патогенез СГЯ
Репродуктивные технологии включают применение антагонистов или агонистов гонадолиберин-рилизинг гормона для стимуляции яичников и человеческого хорионического гонадотропина (ХГЧ) для индукции овуляции. Стимуляция яичников может приводить к их избыточной активации и развитию СГЯ. Развитие этого синдрома связывают с применением экзогенного ХГЧ. Крайне редко СГЯ может возникать при самопроизвольной беременности (чаще в условиях, когда наблюдается повышенная продукция ХГЧ, например, при многоплодной беременности), а также при стимуляции овуляции кломифеном цитратом [8]. Основным характерным признаком, обнаруживающимся при СГЯ, является двустороннее увеличение яичников за счет множественных кист. При морфологическом исследовании в таких яичниках выявляются многочисленные желтые тела, фолликулярные кисты и выраженный отек овариальной стромы. Образование кист в яичниках при СГЯ предположительно связано с непосредственным влиянием стимуляции гонадотропинами, так как сходные изменения в яичниках наблюдаются и при других состояниях, сопровождающихся повышенными уровнями эндогенных гонадотропинов, например, при пузырном заносе, хорионкарциноме и многоплодной беременности.
Патогенез СГЯ пока еще мало изучен. Предполагается, что при СГЯ происходит выброс из яичника вазоактивных субстанций (цитокины, ангиотензин, эндотелиальный сосудистый фактор роста). Это приводит к повышению проницаемости сосудов и выходу белков и жидкости в интерстициальное пространство. В результате развивается асцит, гидроторакс, анасарка, гемоконцентрация и тромбоэмболические осложнения. При СГЯ происходит падение артериального давление, увеличение сердечного выброса, активация ренин-ангиотензин-альдостероновой и симпатоадреналовой системы.
Весьма интересна история развития представлений о патогенезе СГЯ. Впервые подтверждения того, что основным механизмом патогенеза СГЯ является повышение проницаемости капилляров, выло показано в экспериментах на кроликах с использованием внутривенного красителя [15]. При этом основным условием для перехода жидкости из внутрисосудистого пространства в брюшную полость было наличие яичников. СГЯ в экспериментах не удалось индуцировать ни у животных мужского пола, ни у мужчин. Эти эксперименты легли в основу концепции о том, что ключевым фактором для развития СГЯ является наличие яичников, которые секретируют вазоактивный медиатор. Кроме того, позднее при СГЯ был выявлен феномен активации ангиогенеза. В дальнейшем многочисленные эксперименты были направлены на то, чтобы установить этот медиатор, выделяемый яичниками и повышающий проницаемость сосудов. Исходно внимание ученых было обращено к изучению эстрогенов, прогестнинов и пролактина в качестве медиаторов СГЯ, однако прямое патогенетическое значение этих субстанций для развития СГЯ выявить не удалось. Так, развитие асцита у кроликов женского пола не было связано с высокими дозами эстрогенов и прогестерона [7]. Таким образом, повышенный уровень эстрадиола служит маркером ответа яичников на стимуляцию, но не является причиной для возникновения СГЯ.
Доказанным фактом является то, что ренин-ангиотензин-альдостероновая система (РААС) принимает активное участие в механизмах развития СГЯ. С одной стороны, яичники секретируют некоторые компоненты РААС, с другой, на функционирование РААС оказывает непосредственное влияние ХГЧ, который напрямую ассоциирован с СГЯ. Также была подтверждена системная активация РААС в условиях гемодинамических сдвигов у пациенток с СГЯ. Однако остается неясным, могут ли компоненты РААС быть основным патогенетическим звеном СГЯ или эта система активируется вторично в качестве ответа организма на гиповолемию в условиях СГЯ,
Патофизиологические изменения, происходящие в условиях СГЯ, напоминают агрессивно развивающийся системный воспалительный ответ. Однако данные о роли цитокинов в патогенезе СГЯ весьма противоречивы. Эти низкомолекулярные протеины проявляют свою активность в крайне низких концентрациях и реализуют свои эффекты при помощи аутокринных, паракринных и эндокринных механизмов. На активность цитокинов оказывает влияние функциональный статус цитокиновых рецепторов, наличие ингибиторов цитокинов, растворимых рецепторов и связывающих белков. Тем не менее большинство исследований в этой области указывает на повышение уровней медиаторов ранней фазы воспаления (ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-18, ИЛ-18, TNF-альфа и сосудистого эндотелиального фактора роста) и на одновременное снижение уровней иммуносупрессивных и противовоспалительных цитокинов (ИЛ-10) на ранних стадиях развития СГЯ. Существует гипотеза о врожденных дефектах иммунного ответа, обуславливающих повышенный риск СГЯ. Растворимая молекула адгезии клеток сосудов-1 (sVCAM-1) и растворимая молекула межклеточной адгезии-1 (sICAM-1), которые принадлежат к суперсемейству иммуноглобулинов и являются основными медиаторами адгезии лейкоцитов, их взаимодействий с сосудистой стенкой и экстравазации в процессе иммунных и воспалительных реакций, также могут участвовать в патогенезе СГЯ. Это предположение было доказано в одном из исследований по типу случай-контроль по оценке уровней sICAM-1 и sVCAM-1 в перитонеальной жидкости и в плазме крови [16]. Еще в одном исследовании в сыворотке крови и в асцитической жидкости у пациенток с СГЯ были выявлены более высокие уровни sICAM-1 и более низкие уровни растворимого Е-селектина - еще одной молекулы, контролирующей эндотелиальную адгезию [16]. Конкретные механизмы участия этих медиаторов в патогенезе СГЯ еще предстоит установить, однако на данном этапе ясно, что они имеют значение для регуляции сосудистой проницаемости.
Повышение сосудистой проницаемости с последующим развитием асцита при СГЯ связано с субстанциями, накапливающимися в фолликулярной жидкости. Одним из важнейших таких факторов, принимающих участие в патогенезе СГЯ, предположительно является VEGF. Существует несколько доказательств этой гипотезы. Во-первых, уровни VEGF в фолликулярной жидкости превышают таковые в плазме крови. Во-вторых, во время овуляции регистрируется повышение концентрации VEGF в крови. Кроме того, введение ХГЧ стимулирует экспрессию мРНК VEGF лютеинизирующимися клетками гранулезы яичников [17], что объясняет, почему введение ХГЧ часто является критическим фактором для развития СГЯ. Повышенные уровни VEGFв плазме крови и перитонеальной жидкости были выявлены у пациенток с СГЯ по сравнению с контрольной группой [18]. Усиленная экспрессия мРНК VEGF была описана у пациенток с синдромом поликистозных яичников, для которых характерен повышенный риск развития СГЯ. Тем не менее конкретные патогенетические механизмы, посредством которых VEGF обуславливает развитие СГЯ, остаются не до конца известными.
Большой вклад в изучение роли VEGF в патогенезе СГЯ внес Rizk и соавт. (1997) [19]. VEGF представляет собой член семейства гепарин-связывающих протеинов, который непосредственно воздействуют на эндотелиальные клетки и индуцирует процессы пролиферации и ангиогенеза. VEGF кодируется общим геном с фактором сосудистой проницаемости (VPF), которые способствует экстравазации белков в сосудах злокачественных опухолей. В результате транскрипции этого гена при участии альтернативного сплайсинга получаются несколько изоформ VEGF. Семейство VEGF включает четыре разных димерных формы (A-D) и плацентарный фактор роста. Все члены семейства VEGF связываются с тремя рецепторами (VEGF-R 1-3), которые экспрессируются на эндотелиальных клетках. Было идентифицировано и клонировано два рецептора VEGF (VEGFR-1 и VEGFR-2), которые относятся к семейству тирозинкиназных рецепторов. VEGFR-1 экспрессируется на эндотелиальных клетках, клетках трофобласта, моноцитах и мезангиальных клетках в почках. VEGFR-2 также экспрессируется на гемопоэтических стволовых клетках и мегакариоцитах. Экспрессия VEGF стимулируется под действием гипоксии, а также цитокинами и простагландинами. Таким образом, цитокины и факторы роста, непосредственно не стимулирующие ангиогенез, могут модулировать процессы ангиогенеза путем влияния на экспрессию VEGF. Иными словами цитокины могут оказывать непрямой ангиогенный и антиангиогенный эффект. Продукцию VEGF стимулирует трансформирующий фактор роста бета, фактор роста фибробластов-4, фактор роста тромбоцитарного происхождения, инсулиноподобный фактор роста, интерлейкин-1бета и интерлейкин-6, тогда как тромбоспондин и интерлейкин-10 подавляют экспрессию VEGF. VEGF синтезируется и депонируется в гранулах Т-лимфоцитов, тучных клеток, нейтрофилов и мегакариоцитов. VEGF-А или собственно VEGF существует минимум в 5 изоформах, имеющих разную молекулярную массу. Главное, что отличает эти изоформы друг от друга, это способность к связыванию гепарина и гепарин-сульфата.
InvivoVEGF является мощным медиатором сосудистой проницаемости. Он также принимает непосредственное участие в инициации и поддержании ангиогенеза на различных этапах эмбриогенеза, а также в тканях взрослого организма, для которых характерны интенсивные процессы новообразования сосудов, например, в ткани эндометрия и лютеинизирующихся фолликулах. Помимо своей физиологической роли VEGF выполняет свои функции и в условиях патологии, являясь критически важным фактором ангиогенеза при становлении васкуляризации опухолей. Повышенные уровни VEGF также выявляются в перитонеальной жидкости в условиях эндометриоза. VEGF может играть важную роль в регуляции циклических процессов ангиогенеза в яичниках, а его способность повышать сосудистую проницаемость может служить важным фактором для обеспечения продукции секрета маточных труб и появления фолликулярной жидкости, а также жидкости в доброкачественных опухолях яичника, имеющих эпителиальную выстилку, которая содержит VEGF. GordonJD и соавт. (1996) показали, что VEGF в здоровых яичниках локализуется в слое тека-клеток, тогда как содержание этого белка в клетках гранулезы минимальное. VEGF не экспрессируется в атрезирующихся фолликулах и дегенерирующем желтом теле [20]. В то же время высокий уровень VEGF обнаруживается в хорошо васкуляризованном желтом теле. В постменопаузе в яичниках VEGF в норме не выявляется и обнаруживается только в инклюзионных эпителиальных кистах и серозных цистаденомах. На основании этих экспериментальных данных авторы сделали вывод о том, что в течение репродуктивного периода VEGF играет важную роль для процессов роста и поддержания функции фолликулов и желтых тел в яичнике, что осуществляется на уровне модуляции ангиогенеза.
Молекулярно-биологические исследования свидетельствуют о четкой взаимосвязи между VEGF и ХГЧ [19]. Было показано, что экспрессия мРНК VEGF у крыс и в яичниках приматов происходит преимущественно после пика ЛГ. Этот пик ЛГ также является ключевым фактором и для развития СГЯ. Кроме того, использование антагониста ГнРГ в лютеиновую фазу с целью подавления выброса ЛГ приводит к торможению экспрессии мРНК VEGF. Отсюда ясно, почему использование прогестерона для поддержки лютеиновой фазы снижает вероятность развития СГЯ по сравнению с ХГЧ. Экспрессия VEGF под влиянием ХГЧ в яичниках осуществляется в клетках гранулезы и зависит от его дозы. Активность VEGF нарастает в процессе роста граафова фолликула и достигает пика при формировании желтого тела [21]. Было показано, что именно повышенная суммарная продукция VEGF на уровне фолликулов обуславливает нарастание уровней VEGF в плазме крови, что ассоциируется с развитием СГЯ [22].
Фактор фон Виллебранда (vWF) считается маркером активации эндотелиальных клеток. Его концентрация повышается в условиях избыточной экспрессии VEGF эндотелиальными клетками. Было показано, что повышенные уровни vWF в день переноса эмбрионов коррелируют с тяжестью СГЯ, а повышение уровней vWF предшествует развитию тяжелого СГЯ [23]. Однако такого повышения уровней vWF не было зарегистрировано в фолликулярной жидкости, что указывает на то, что повышенные уровни vWF не могут быть яичникового происхождения. По всей видимости, источником vWF при СГЯ является эндотелий, а на выброс vWF оказывают вазоактивные медиаторы овариального происхождения. У пациенток с СГЯ по сравнению с женщинами с высоким ответом на стимуляцию было выявлено более выраженное повышение уровней vWF за день до забора ооцитов, причем повышенные уровни vWF сохранялись в условиях СГЯ в течение всей лютеиновой фазы, тога как у пациенток без СГЯ уровни vWF прогрессивно снижались после забора ооцитов [24]. Снижение уровней vWF при СГЯ сопровождает клиническое улучшение. Таким образом, в клинической практике повышенные уровни vWF можно рассматривать в качестве прогностических для развития СГЯ и в качестве дискриминаторного параметра. Однако vWF предположительно играет роль в генезе формирования патологического каскада реакций в условиях СГЯ в качестве вторичного медиатора, который выделяется эндотелиальными клетками в ответ на их стимуляцию фактором яичникового происхождения.
Вазоконстриктор эндотелин-1 является еще одном фактором, повышающим сосудистую проницаемость. При СГЯ его концентрация в фолликулярной жидкости в 100-300 раз превышает таковую в плазме крови. У пациенток с СГЯ выявляется повышение плазменных уровней эндотелина-1, однако его концентрации нарастают параллельно с содержанием в крови других нейрогуморальных вазоактивных факторов и коррелируют с тяжестью СГЯ [25], что может говорить о том, что повышение уровней эндотелин-1 является частью ответа организма, направленного на сохранение гомеостаза, а не инициирующим фактором в развитии СГЯ.
Роль эндотелия в патогенезе СГЯ. Впервые роль эндотелия в патогенезе СГЯ была показана в элегантном исследовании Albert С. и соавт. (2002) [18]. В основу этой гипотезы легли более ранние наблюдения о более высоком уровне VEGF в плазме крови по сравнению с фолликулярной жидкостью у женщин из группы риска развития СГЯ [26]. Это свидетельствует о том, что другие клетки помимо фолликулярных могут быть источником и мишенями для VEGF. Для тестирования этой гипотезы Albert С. и соавт. создали invitro модель, в которой проверяли воздействие эстадиола и ХГЧ на человеческий микрососудистый эндотелий с целью оценки способности эндотелиальных клеток к экспрессии и секреции медиаторов, которые могут быть вовлечены в патогенез СГЯ [18]. В результате этих экспериментов было показано, что эндотелий является источником VEGF и ИЛ-6. Эти медиаторы могут реализовывать свое воздействие на паракринном и аутокринном уровне, индуцируя изменения в сосудах, связанные с СГЯ, Рецепторы к VEGF и ИЛ-6 были обнаружены в клетках желтого тела. Кроме того, была установлена роль этих рецепторов для повышения сосудистой проницаемости у человека [27]. Albert С. и соавт. в своем исследовании установили, что ХГЧ индуцирует экспрессию KDR в эндотелиальных клетках человека - наиболее функционального рецептора VEGF, который регулирует митогенез, ангиогенез и процессы перестройки цитоскелета [18]. Эта усиленная экспрессия рецептора KDR, по всей видимости, и является ключевой причиной для резкого увеличения проницаемости сосудов в условиях СГЯ. Схематично патогенетическая роль эндотелия в условиях СГЯ отображена на рис. 1. Непрерывность архитектоники цитоскелета в эндотелиальных клетках является важным фактором сохранения функций эндотелиального барьера. Проницаемость эндотелия для воды и солей зависит от формы и конфигурации эндотелиоцитов. Эта же группа ученых выявила нарушение регулярности эндотелиального слоя, перестройку активных филаментов и морфологические изменения в эндотелиоцитах под действием ХГЧ. В то же время сам по себе эстрадиол не способен индуцировать экспрессию рецепторов VEGF и не повышает сосудистую проницаемость. Таким образом, блокада VEGF или его рецептора с использованием, например, специфических антител, может быть привлекательной мишенью для разработки новых методов для профилактики и лечения СГЯ.
Рисунок 1.
Роль эндотелиальных клеток в патогенезе СГЯ

VEGF- сосудистый эндотелиальный фактор роста, KDR- рецептор VEGF, ИЛ-6 - интерлейкин-6, ХГЧ - хорионический гонадотропин человека
Таким образом, основную гипотезу развития СГЯ в настоящее время можно представить следующим образом (рис. 2). В условиях СГЯ происходит нарушение регуляции процесса овуляции, что сопровождается гиперпродукцией провоспалительных факторов в яичниках. В результате происходит вторичное увеличение проницаемости капилляров и переход воспалительных медиаторов в другие компартменты. При наиболее тяжелых формах СГЯ этот процесс сопровождается системными проявлениями.
Рисунок 2.
Патофизиология СГЯ

sVCAM-1 - растворимая молекула сосудистой адгезии-1, TNF- фактор некроза опухолей,VEGF- сосудистый эндотелиальный фактор роста,VEGFR-1 - рецептор сосудистого эндотелиального фактора роста, vWF- фактор фон Виллебранда
Классификация СГЯ была предложена RabauE. в 1967 году. Он выделял три клинических категории СГЯ (легкий, средней тяжести, тяжелый) и шесть степеней тяжести, выделенных на основании клинических и лабораторных признаков. В дальнейшем эта классификация была модифицирована MathurR и соавт. (2007) [28]:
Таблица 3.
Классификация СГЯ
| Легкий СГЯ | вздутие живота
слабо выраженная боль в животе увеличение яичников до <8 см |
| СГЯ средней тяжести | умеренно выраженная боль в животе
тошнота +/- рвота увеличение яичников до 8-12 см наличие признаков асцита по данным УЗИ |
| СГЯ тяжелой степени | клинически выраженный асцит (в ряде случаев плевральный выпот)
олигурия гемоконцентрация (гематокрит >45%) гипопротеинемия увеличение яичников >12 см |
| Критический СГЯ | напряженный асцит или массивный плевральный выпот
гемоконцентрация (гематокрит >55%) лейкоцитоз >25000 олигурия/анурия тромбоэмболические осложнения острый респираторный дистресс-синдром |
Критериями тяжести СГЯ является нарушение функции печени, гемоконцентрация, лейкоцитоз, почечная недостаточность, анасарка. Выделяют также жизнеугрожающий или критический СГЯ, который включает в себя увеличение размера яичников, развитие острого респираторного дистресс-синдрома, напряженного асцита, гидроторакса, анасарки, перикардиального выпота, тяжелой почечной недостаточности и тромбоэмболические осложнения. Критерии тяжести СГЯ суммированы в табл. 4.
Таблица 4.
Критерии тяжести СГЯ
| Тяжелый СГЯ | Жизнеугрожающий СГЯ |
| Увеличения размера яичников
Асцит, гидроторакс, анасарка Гематокрит >45% Лейкоцитоз >15 000 Олигурия Креатинин до 1,6 мг/дл Скорость клубочковой фильтрации >50 мл/мин Дисфункция печени |
Увеличения размера яичников
Напряженный асцит, гидроторакс, анасарка Гематокрит >55% Лейкоцитоз >25 000 Креатинин >1,6 мг/мл Скорость клубочковой фильтрации <50 мл/мин Тромбоэмболические осложнения Острый респираторный дистресс-синдром |
СГЯ обычно развивается примерно через 20 дней (в период от 5 до 45 дней) после индукции овуляции [19]. Выделяют раннее начало синдрома - через 3-5 дней назначения овуляторных доз ХГЧ, и позднее начало СГЯ. Последнее бывает обусловлено нарастанием ХГЧ в условиях наступившей беременности и клинически является более тяжелой формой.
Клинические проявления СГЯ
СГЯ является тяжелым осложнением стимуляции овуляции, которое может привести в том числе и к фатальному исходу. С момента внедрения гонадотропинов в клиническую практику для индукции овуляцию был зарегистрирован целый ряд смертельных случаев, косвенно или напрямую связанных с СГЯ. Впервые летальный случай был описан в 1951 году Gotzsche, который сообщил о фатальном артериальном тромбозе - тотальной окклюзии левой внутренней сонной артерии у 37-летней пациентки с бесплодием, получавшей терапию гонадотропином. В последующем были описаны и другие летальные случаи, связанные с СГЯ, когда причиной смерти была массивная тромбоэмболия и ишемический инсульт (Mozws, 1965, Cluroe 1995). Таким образом, тромбозы и эмболии можно рассматривать как наиболее тяжелые осложнения СГЯ, которые могут привести к летальному исходу, инвалидизации вследствие инсульта и ампутации конечностей.
Массивный переход жидкости в интерстициальное пространство характеризуется развитием асцита, гидроторакса, перикардиального выпота, электролитными нарушениями, олигурией, гемоконцентрацией, гиповолемическим шоком. Первым проявлением СГЯ обычно бывают дискомфорт в животе, тошнота, рвота, диарея. Развитие диареи и рвоты, возникновение одышки, одышки, асцита в течение первых 48 часов после назначения ХГЧ свидетельствуют о тяжелом течении заболевания. При физикальном обследовании обнаруживается прибавка массы тела, увеличение объема живота, симптомы гиповолемии. Через брюшную стенку пальпируются увеличенные яичники. Особое внимание следует уделить осмотру конечностей и шеи, чтобы не пропустить тромбоз.
Данные лабораторных исследований свидетельствуют об электролитных нарушениях (гиперкалиемия и гипонатриемия), гемоконцентрации, гипоальбуминемии, повышении уровня креатинина. Примерно у 30% пациенток выявляются нарушения функции печени (умеренная гиперферментемия). При СГЯ вследствие перехода плазмы крови в экстравазальное пространство происходит значительное снижение уровня IgG и IgA в плазме крови, что делает пациентов с СГЯ чувствительными к развитию инфекционных осложнений. При анализе асцитической жидкости выявляется высокая концентрация белка, низкое содержание лейкоцитов и высокий уровень эритроцитов. При ультразвуковом исследовании выявляются множественные фолликулярные кисты и асцит.
Причиной развития дыхательной недостаточности при СГЯ могут служить компрессия легких вследствие асцита, плеврита, перикардиального выпота, развития ОРДС, тромбоэмболии, отека легких, ателектаза, внутриальвеолярных кровоизлияний. В большинстве случаев плевральный выпот развивается с двух сторон и наблюдается одновременно с асцитом. Однако описаны случаи возникновения одностороннего плеврального выпота в качестве единственного симптома СГЯ. Односторонний выпот чаще развивается с правой стороны.
Интересно, что если при спонтанно наступившей беременности тромбозы затрагивают преимущественно (в 70% случаев) глубокие вены нижних конечной (илиофеморальный сегмент), то тромбозы, возникающие вследствие индукции овуляции, локализуются в основном в венах верхней части тела. Хотя увеличение размеров яичников при СГЯ, казалось бы, способствует стазу крови в тазовых венах и венах нижних конечностей. В большинстве случаев (60%) тромбозы, связанные с ЭКО, развиваются в яремной вене, подключичной, подмышечной венах, а также венах головного мозга. Последнее является наиболее тяжелым осложнением. Летальность при тромбозе церебральных вен достигает 5-30%, при этом более опасны тромбозы синусов головного мозга. Интересно, что исход тромбозов церебральных вен у беременных и в послеродовом периоде более благоприятный, чем при церебральных тромбозах, не связанных с беременностью. Полное выздоровление, по данным анализа OuY. и соавт. (2003), наблюдалось у 49% женщин с церебральными тромбозами и у 79% с тромбозами других локализаций [12]. В большинстве случаев развиваются венозные тромбозы, однако у 25% пациентов могут иметь место и артериальные тромбозы (в основном инсульты). В 75% тромбозы развиваются у пациенток с наступившей беременностью, у 66% выявляется СГЯ [12].
По данным KodamaH. и соавт. (1996), маркеры активации коагуляции и фибринолиза (ТАТ, РАР) остаются повышенными после индукции овуляции на протяжении 3-4 недель у женщин с наступившей беременностью [4]. Поэтому развитие тромбоэмболических осложнений возможно и после купирования симптомов СГЯ. В течение первых двух дней после стимуляции овуляции активируется коагуляционный каскад и лишь потом фибринолитическая система. Ранняя активация коагуляции, возможно, является причиной развития субклинических тромбозов. Вероятно, меньший диаметр церебральных сосудов объясняет более раннее развитие клинических проявлений при тромбозах данной локализации (в среднем через 10 дней после стимуляции овуляции). Множественные тромбозы мелких сосудов мозга могут протекать практически бессимптомно или проявляться в виде стертой неврологической симптоматики [29], кроме того, при аутопсии выявляются множественные тромбозы с вовлечением сосудов мозга различного диаметра [30].
Возникновение тромбозов связывают с повышением уровня эстрадиола в крови, гемоконцентрацией и гиповолемией. При повышении уровня эстрогенов возрастает содержание тромбоцитов, фибриногена, vWF и снижается уровень ATIII. Вследствие гемоконцентрации увеличивается вязкость крови и концентрации факторов коагуляции.
Тромбоэмболические осложнения при СГЯ чаще развиваются у пациенток с генетическими формами тромбофилии (дефицит протеинов С, S, ATIII) [12]. Поэтому расширенное исследование системы гемостаза с определением генетических форм тромбофилии и маркеров АФС у пациенток с СГЯ мы считаем обязательным.
Лечение СГЯ
Специфическое лечение СГЯ отсутствует, и терапия сводится в основном к симптоматической. Симптомы СГЯ обычно проходят самостоятельно с уменьшением уровня ХГЧ (в течение 7 дней у небеременных и в течение 10-20 дней у беременных пациенток). Пациенткам требуется полный покой и строгий постельный режим в течение 2-3 недель.
Ежедневно требуется контроль массы тела, диуреза. Рекомендуется выпивать в день более 1 литра жидкости, содержащей электролиты. При среднетяжелом и тяжелом СГЯ следует избегать проведения влагалищного обследования в связи с риском разрыва киста яичника и развития кровотечения. Требуется ежедневный контроль креатинина, электролитов, гематокрита, гемоглобина, клеточного состава крови, печеночных ферментов, коагулограммы, по возможности - бета-ХГЧ [37]. Желательно установить подключичный катетер, что связано с меньшим риском развития тромботических осложнений, чем наличие периферического катетера. При развитии дыхательной недостаточности при отсутствии плеврального выпота или при сомнительных результатах рентгенографии легких требуется исключение ТЭЛА (КТ, вентиляционно-перфузионная сцинтиграфия). Обязательным компонентом лечения является инфузионная терапия. Ее задачами является восстановление ОЦК, ликвидация гемоконцентрации, борьба с почечной недостаточностью. Предпочтительно вводить физиологический раствор и глюкозу. Восстановление электролитного баланса, повышение осмотического давления крови способствует переходу жидкости из внеклеточных пространств обратно в сосудистое русло. При выраженной гиповолемии, гемоконцентрации (гематокрит >45%), гипоальбуминемии (<3 г/дл) рекомендуется применение альбумина и/или свежезамороженной плазмы, которая позволяет также коррегировать показатели системы гемостаза. Важно отметить, что применение диуретиков в условиях гиповолемии и гемоконцентрации, а также их передозировка увеличивают риск развития тромбоэмболических осложнений.
При плевральном выпоте обычно проводится консервативное лечение. Плевральная функция показана при прогрессировании дыхательной недостаточности. Асцит также рекомендуется вести консервативно. Показаниями к парацентезу является напряженный асцит, почечная недостаточность, резистентная к консервативной терапии. Парацентез проводится трансабдоминально или трансвагинально под контролем УЗИ, что позволяет снизить риск повреждения увеличенных яичников. Восстановление функции почек после парацентеза связывают с восстановлением перфузии почек, венозного оттока, нормализацией сердечного выброса. У пациенток с тяжелым СГЯ нередко приходится выполнять парацентез 2-3 раза в неделю. Abuzeid М. и соавт. (2003) предложили применять у таких пациенток постоянный катетер по типу хвоста свиньи [31]. Также при тяжелом СГЯ было предложено наложение перитонеально-венозных шунтов, что позволяет возвращать перитонеальную жидкость в сосудистое русло. При этом удается восполнить потери иммуноглобулинов [12].
В связи с повышенным риском развития инфекционных осложнений у пациенток c СГЯ целесообразным является профилактическое назначение антибиотиков. Риск инфекционных осложнений можно снизить, применяя инвазивные процедуры (лапарацентез, плевральную пункцию) строго по показаниям. Следует отметить, что в 50% случае AbramovY. и соавт. (1998) не выявили возбудителей у пациенток с признаками развития сепсиса [32]. Это может быть связно с тем, что само течение СГЯ является проявлением синдрома системного воспалительного ответа, связанного с массивным выбросом цитокинов и играющего ведущую роль в развитии состояния гиперкоагуляции.
Обязательным является профилактическое назначение антикоагулянтов под контролем маркеров тромбофилии (D-димер) [38]. Препаратом первого выбора для лечения тромботических осложнений СГЯ является НМГ. НМГ должны назначаться всем пациенткам, находящимся на стационарном лечении по поводу СГЯ. При стойкой тяжелой неврологической симптоматике, тромбозе венозных синусов возможно проведение прицельного тромболизиса и тробэктомии. Целесообразно проводить скрининг на наличие генетических форм тромбофилии и АФС, особенно у женщин с тромботическими осложнениями, а также профилактическое применение НМГ у таких пациенток. Важно обеспечить адекватную инфузионную терапию для снижения гемоконцентрации.
По последним данные, учитывая патогенез СГЯ с развитием гиперкоагуляции, воспаления, ДВС-синдрома, возможным эффективным методом терапии может быть применение рекомбинантного активированного протеина С, который уже доказал свою эффективность при тяжелом сепсисе [33]. Однако эта гипотеза требует дальнейших подтверждений.
Сообщается также о новых подходах к лечению СГЯ, которые основаны пока преимущественно на данных экспериментальных исследований на животных. Для терапии СГЯ, в частности, предается применять индометацин, блокирующий синтез простагландинов, которые могут быть одним из патогенетических факторов развития СГЯ. Однако в ретроспективном исследовании BorensteinR. и соавт. (1989) преимуществ использования индометацина показано не было [34]. Более того, в настоящее время применение нестероидных противовоспалительных препаратов при СГЯ не рекомендуется, так как они могут оказывать неблагоприятное влияние на процессы имплантации и усугубить развивающиеся в условиях тяжелого СГЯ нарушения функции почек [35]. Одной из теорий патогенеза СГЯ является выброс гистамина и гистаминоподобных субстанций из яичника. Отчасти эту теорию подтверждает тот факт, что аллергии являются фактором риска развития СГЯ. В исследованиях на животных антигистаминные препараты были эффективными для предотвращения развития СГЯ [36], однако для подтверждения этих предположений требуются проспективные исследования с участием человека.
Резекция яичников при СГЯ категорически противопоказана. Хирургической вмешательство, предпочтительно лапароскопическое, необходимо только при разрыве кисты яичника, перекруте кисты, кровотечении. Перекрут кисты яичника следует заподозрить при появлении болей в нижнем отделе живота и обнаружении уплотненного болезненного образования при пальпации. Снижение гематокрита может быть связано с восстановлением ОЦК, однако прежде всего при этом следует исключать развитие кровотечения.
Редко при неэффективности консервативного лечения при тяжелом течении СГЯ для снижения уровня ХГЧ требуется прерывание беременности.
Профилактика СГЯ включаетвведение ХГЧ только при приемлемом уровне эстрадиола, применение прогестерона, а не ХГЧ в лютеиновую фазу. Кроме того, нами была разработана схема профилактики тромбоэмболических осложнений при подготовки и проведении программ вспомогательных репродуктивных технологий.
Рекомендации по профилактике тромбозов у пациенток, включенных в программы ЭКО
При планировании ЭКО к выбору профилактики венозных тромбоэмболических осложнений следует подходить индивидуально, взвешивая все факторы риска. Особое внимание необходимо уделить оценке состояния системы гемостаза, включая наследственные и приобретенные формы тромбофилии. Согласно международным рекомендациям (табл. 5) введение НМГ следует начинать с утра в день стимуляции овуляции гонадотропинами. Для сведения к минимуму геморрагических осложнений во время забора яйцеклетки в день процедуры НМГ вводить не следует; инъекции НМГ возобновляют на следующий день. В день переноса эмбриона с утра НМГ не вводится. Затем НМГ применяют в профилактических дозах вплоть до подтверждения беременности. В случае наступления беременности профилактическую антикоагулянтную терапию продолжают.
Таблица 5.
Рекомендации по профилактике тромбоэмболических осложнений у женщин, включенных в программы ЭКО
| Клиническая ситуация | Тактика ведения |
| Один эпизод ВТЭ в анамнезе, не связанный с беременностью или приемом оральных контрацептивов), возникший на фоне транзиторных факторов риска и при отсутствии дополнительных факторов риска, например, ожирения | Динамическое наблюдение или профилактические дозы НМГ (эноксапарин 40 мг, фраксипарин 0,3 мл, фрагмин 5000 МЕ один раз в день) +/- компрессионное белье |
| Один идиопатический эпизод ВТЭ в анамнезе или один эпизод ВТЭ в анамнезе при наличии тромбофилии у пациенток, не получающих постоянную антикоагулянтную терапию, или один случай ВТЭ в анамнезе при наличии дополнительных факторов риска (например, ИМТ >35) | Профилактические дозы НМГ (эноксапарин 40 мг, фраксипарин 0,3 мл, далтепарин 5000 МЕ один раз в день) до стимуляции овуляции и в течение всей беременности +/- компрессионное белье. При дефиците антитромбина необходимо назначение более высоких доз НМГ (эноксапарин 0,5 1 мг/кг, далтепарин 50-100 МЕ/кг каждые 12 часов) |
| Более одного эпизода ВТЭ в анамнезе при отсутствии данных о тромбофилии у пациенток, не получающих постоянную антикоагулянтную терапию | Профилактические дозы НМГ до стимуляции овуляции и в течение всей беременности + компрессионное белье |
| Один или более эпизодов ВТЭ в анамнезе у пациенток, получающих постоянную антикоагулянтную терапию (например, при наличии тромбофилии) | Переход с пероральных антикоагулянтов на НМГ (эноксапарин 0,5 1 мг/кг, далтепарин 50-100 МЕ/кг каждые 12 часов) до контролируемой стимуляции овуляции, продолжение применения НМГ в течение всей беременности + компрессионное белье |
| Подтвержденная тромбофилия при отсутствии ВТЭ в анамнезе | Динамическое наблюдение или профилактические дозы НМГ +/- компрессионное белье. Профилактику настоятельно рекомендуется проводить при наличии дефицита антитромбина III, кроме того, лечение в пользу активного ведения следует принять при наличии симптомных ВТЭ в семейном анамнезе и дополнительных факторов риска |
| Наличие факторов риска ВТЭ при отсутствии тромбофилии и ВТЭ в анамнезе | Необходимо проведение индивидуальной оценки риска. При наличии нескольких факторов риска, включая высокий ИМТ, гиподинамию, тяжелые формы гестоза в анамнезе решение следует склонить в пользу активной профилактики: профилактические дозы НМГ +/- компрессионное белье. При высоком ИМТ может потребоваться коррекция дозы НМГ |
| Синдром гиперстимуляции яичников | Профилактические дозы НМГ +/- компрессионное белье. При отсутствии наступления беременности антикоагулянтная терапия может быть закончена после разрешения симптомов. В случае наступления беременности применение НМГ следует продолжить минимум до конца первого триместра. А в дальнейшем в зависимости от показателей системы гемостаза и наличия дополнительных факторов риска ВТЭ |
| Развившаяся ВТЭ | Терапевтические дозы НМГ (например, 1 мг/кг эноксапарина или 90 МЕ/кг далтепарина каждые 12 часов). Антикоагулянтная терапия должна быть продолжена в течение не менее 6 недель после родов |
Нами разработана тактика подготовки к ЭКО и ведения беременности у пациенток с бесплодием и тромбофилией. При подготовке пациенток с бесплодием, с повторными неудачами ЭКО и тромбофилиями к программе ЭКО мы проводим дифференцированную противотромботическая профилактику в зависимости от причины тромбофилии и степени ее выраженности, а также гирудотерапию в течение 1,5 месяца до программы ЭКО. В качестве антитромботической терапии мы используем низкомолекулярный гепарин, начиная с фертильного цикла, а именно в процессе стимуляции овуляции. Терапия отменяется за сутки до планируемой пункции и через 12 ч. после подсадки эмбрионов возобновляется. Также параллельно мы назначаем минидозы аспирина 50-75 мг 1 раз в сутки, начиная с фертильного цикла в зависимости от агрегационной активности тромбоцитов. Всем женщинам назначаются витамины, полиненасыщенную жирную кислоту (омега-3) и антиоксиданты. В случае обнаружения MTHFR C667T обязательно дополнительно назначение фолиевой кислоту (4 мг/сут), а также витамины группы В. Низкомолекулярные гепарина мы применяем на протяжении всей беременности, за сутки до родов (кесарево сечение) препарат отменяется, через 8 ч. терапия возобновляется до 10-го дня послеродового/послеоперационного периода. Контролем эффективности противотромботической терапии служат маркеры тромбинемии и фибринообразования (ТАТ, F1+2, D-димер). Начало программы ЭКО у пациенток с тромбофилией, как наследственной, так и приобретенной, в условиях выраженной активации системы гемостаза и/или повышенных уровней антифосфолипидных антител мы считает противопоказанным до проведения адекватной подготовки к беременности с применением антикоагулянтной терапии и нормализации или улучшения показателей системы гемостаза.
Девочки нашла тут статью, хочу поделиться. Если б в свое время я была бы более внимательной к таким вещами (не говорю о врачах) ЭТОГО можно было бы избежать  Тромботические осложнения являются наиболее серьезными, потенциально смертельными осложнениями вспомогательных репродуктивных технологий. Частота использования искусственных репродуктивных технологий продолжает активно увеличивает, так в 2004 году в Европе эти методики были применены более чем у 250 000 женщин [1]. У женщин, включаемых в программы ЭКО, имеет место объективно более высокий риск венозных тромбоэмболических осложнений (ВТЭ). Это связано с их более старшим возрастом, высокой распространенность метаболического синдрома и сопутствующей патологии. Нельзя также не учитывать четкую взаимосвязь между бесплодием и тромбофилическими состояниями, как генетически обусловленными, так и приобретенными, включая антифосфолипидный синдром (АФС). Несмотря на то, что частота ВТЭ у этой группы пациенток согласно мировым данным невысока (0,08-0,11%) [2], учитывая тяжелые осложнения ВТЭ, в том числе и фатальные, а также повышенный риск ВТЭ у пациенток, включаемых в программы ЭКО, этот вопрос требует особого внимания.
Тромботические осложнения являются наиболее серьезными, потенциально смертельными осложнениями вспомогательных репродуктивных технологий. Частота использования искусственных репродуктивных технологий продолжает активно увеличивает, так в 2004 году в Европе эти методики были применены более чем у 250 000 женщин [1]. У женщин, включаемых в программы ЭКО, имеет место объективно более высокий риск венозных тромбоэмболических осложнений (ВТЭ). Это связано с их более старшим возрастом, высокой распространенность метаболического синдрома и сопутствующей патологии. Нельзя также не учитывать четкую взаимосвязь между бесплодием и тромбофилическими состояниями, как генетически обусловленными, так и приобретенными, включая антифосфолипидный синдром (АФС). Несмотря на то, что частота ВТЭ у этой группы пациенток согласно мировым данным невысока (0,08-0,11%) [2], учитывая тяжелые осложнения ВТЭ, в том числе и фатальные, а также повышенный риск ВТЭ у пациенток, включаемых в программы ЭКО, этот вопрос требует особого внимания.
Изменения гемостаза, связанные со стимуляцией овуляции
Стимуляция овуляция приводит к возникновению состояния гиперэстрогении. При этом, как и в случае применения оральных контрацептивов и препаратов заместительной гормональной терапии, в результате воздействия экзогенных эстрогенов формируется состояние гиперкоагуляции. Исследования, посвященные изучению влияния сверхфизиологических уровней эстрогенов на систему гемостаза, очень ограничены. Кроме того, интерпретация их результатов осложняется использованием различных протоколов стимуляции овуляции, а также тем, что в эти исследование было включено очень небольшое количество пациенток. В целом результаты этих исследований свидетельствуют о том, что уровни эстрадиола коррелируют с концентрацией фибриногена, уровнями D-димера и резистентностью к АРС [3]. Кроме того, стимуляция овуляции также ассоциируется с увеличением уровней некоторых факторов свертывания крови: фактора V, фибриногена, фактора Фон Виллебранда. Одновременно выявляется повышение маркеров активации система гемостаза - фрагментов протромбина F 1+2 и D-димера и нарушение функций эндогенной антикоагулянтной системы, что проявляется снижением уровней антитромбина и протеина S. Резистентность к АРС увеличивает при стимуляции овуляции и сохраняется на повышенном уровне при проведении поддержки лютеиновой фазы. Важно отметить, что нарушение функции естественных антикоагулянтов и развитие резистентности к АРС представляет особый риск у пациенток с мутацией FV Leiden и антифосфолипидным синдром, когда уже исходно имеющаяся резистентность к АРС определяется фоновое повышение риска тромбоэмболических осложнений.
В еще большей степени эти изменения гемостаза развиваются при синдроме гиперстимуляции яичников (СГЯ). СГЯ сопровождается повышением уровней фибриногена, D-димера, комплексов тромбин-антитромбин и F1+2, снижением уровня прекалликреина и тканевого фактора [4], причем эти изменения сохраняются в течение нескольких недель. Интересно, что повышенные уровни D-димера и комплексов тромбин-антитромбин ассоциируется с неудачами ЭКО [3]. Подобная взаимосвязь между избыточной активацией коагуляции и неудачными результатами ЭКО еще раз подтверждает важность механизмов гемостаза в процессе имплантации. В отличие от нормальных циклов стимуляции овуляции, когда наблюдаются минимальные изменения гематокрита, при СГЯ имеет место выраженная гемоконцентрация, что многократно повышает риск ВТЭ.
Следует обратить внимание на то, что клиническая картина ВТЭ при стимуляции овуляции редко развивается до введения хорионического гонадотропина (ЧХГ). Это наблюдение поставило перед учеными вопрос о роли ЧХГ для активации системы гемостаза. Было показано, что после назначения ЧХГ происходит повышение уровней фибриногена, факторов II, V, VII, VIII и IX. Вслед за такой активацией прокоагулянтных механизмов с задержкой на 2 дня запускаются фибринолитические механизмы, пик активности которых достигает через 8 дней [4]. Кроме того, при использовании очищенного ФСГ мочевого происхождения, которые также содержат ЧХГ, наблюдается снижение уровней протеина С и антитромбина, в то время как для рекомбинантного ФСГ эти изменения не были статистически достоверными по сравнению с женщинами с нормальным менструальным циклом [5]. Таким образом, гиперкоагуляция, связанная с гиперэстрогенией, имеющая место во время стимуляции овуляции, может усиливаться под действием ЧХГ, что имеет место и во время физиологической беременности.
В большинстве случаев для развития тромбоза требуется «синнергичный» эффект нескольких факторов риска (табл. 1).
Таблица 1.
Патогенез тромботических осложнений в условиях стимуляции овуляции и СГЯ
| Гемоконцентрация
Сдавление тазовых вен Состояние гиперкоагуляции Тромбофилические состояния Личный или семейный анамнез тромботических осложнений Нарушение реактивности сосудов |
Риск тромбоэмболических осложнений при использовании вспомогательных репродуктивных технологий
Несмотря на описанные выше выраженные изменения гемостаза, которые возникают при использовании вспомогательных репродуктивных технологий, общая частота ВТЭ в абсолютных значениях остается не высокой. В целом риск ВТЭ у женщин, включенных в программы ЭКО, в 10 раз превышает риск ВТЭ у женщин репродуктивного возраста, который составляет 2-3 на 10 000 человек в год. В то же время при наличии СГЯ тромбоэмболические осложнения развиваются у одной из 128 женщин, таким образом, риск ВТЭ по сравнению с общей популяцией возрастает в 20-40 раз [6]. Согласно недавнему обзору Nelson S.M. и соавт. (2008), при литературном поиске авторам удалось идентифицировать 109 описанных случаев тромбоэмболических осложнений, связанных с использованием вспомогательных репродуктивных технологий [1]. В 70% имели место венозные тромбоэмболические осложнения. Интересно, что в отличие от наиболее часто развивающихся во время беременности илиофеморальных тромбозов, у этих пациентов преобладали тромбозы глубоких вен верхних конечностей, включая тромбозы подключичной и внутренней яремной вены. В качестве одного из возможных патофизиологических механизмов этого явления считают особенности дренирования перитонеальной жидкости, содержащей высокие уровни эстрогенов, в грудной лимфатический проток. В этом случае, вероятно, роль играет сочетание нескольких факторов: анатомических особенностей, состояния гиперкоагуляции, обусловленного экзогенными факторами, и наличие тромбофилий. В 30% случаев тромбозы развиваются у женщин, у которых беременность не наступила. Более того, время до развития тромбоза оказалось больше, чем было принято считать ранее. В среднем тромбоэмболические осложнения развиваются через 40 дней после переноса эмбриона и через 27 дней после индукции овуляции [2]. Описаны случаи тромбозов на фоне стимуляции овуляции в лютеиновую фазу, а также отсроченные тромботические осложнения через 6-7 недель после овуляции. У женщин с СГЯ тромбоэмболические осложнения развивались от нескольких дней до нескольких недель после разрешения симптомов. Более того, описан случай тромбоза после ЭКО на 20-й неделе беременности. Все это свидетельствует о длительной персистенции генерализованных изменений в системе гемостаза в сторону гиперкоагуляции на фоне стимуляции овуляции, о чем нужно всегда помнить при выработке тактики профилактики тромбозов у женщин, вступающих в программу ЭКО.
Артериальные тромбозы у пациенток, включенные в программы ЭКО, развиваются реже, чем венозные, и в более короткие сроки: в среднем через 10-14 дней после переноса эмбриона.
Роль тромбофилии в патогенезе тромботических осложнений программ вспомогательных репродуктивных технологий
Важно помнить о том, что тромбоэмболические осложнения могут развиваться и при отсутствии тяжелого СГЯ, сопровождающегося гемоконцентрацией. По данным Delvigne А. и соавт. (2004), у пациенток с тромбозами в 12% имел место СГЯ средней тяжести и примерно у такого же процента пациенток - СГЯ легкой степени [7]. Кроме того, тяжелые формы СГЯ выявляются у 0,56-6,5% женщин с СГЯ, тогда как тромботические осложнения развиваются у 1 из 128 женщин с СГЯ. Таким образом, для развития тромбозов значение могут иметь и другие фоновые факторы риска тромботических осложнений, в частности, наследственная и приобретенная тромбофилия. Наследственная тромбофилия была выявлена у 23% женщин с СГЯ, причем в 18% обнаружена мутация FVLeiden [8]. Dulitzkyи соавт. (2002) провели проспективную оценку маркеров тромбофилии, включая плазменные уровни антитромбина III, протеина S, протеина С, антифосфолипидных антител, мутацию FVLeiden и MTHFRC677T, у пациенток, госпитализированных в связи с тяжелым СГЯ. При этом один или более маркеров тромбофилии были положительными у 85% женщин. В контрольной группе ни в одном случае не было обнаружено более одного маркера тромбофилии, а частота выявления одного маркера составила 27% [9]. Кроме того, описаны случаи тромботических осложнений на фоне стимуляции овуляции у пациенток с отягощенным семейным анамнезом по тромбозам, при этом известные тромбофилии выявлены не были. Это может свидетельствовать о роли еще не изученных наследственных нарушений в системе гемостаза в патогенезе тромбозов, связанных с использованием вспомогательных репродуктивных технологий. В связи с этим при планировании стимуляции овуляции и стратегий профилактики тромботических осложнений особое внимание необходимо уделять оценке личного и семейного тромботического анамнеза.
Оценка факторов риска тромботических осложнений перед использованием вспомогательных репродуктивных технологий
Перед включением пациенток в программы вспомогательных репродуктивных технологий необходима индивидуальная оценка факторов риска, включая наличие тромбофилических состояний, отягощенного семейного и личного тромботического анамнеза, индекса массы тела, сопутствующих заболеваний, возраста (> 40 лет). Важно отметить, что многократные неудачи ЭКО ассоциируются с высокой частотой тромбофилий, таким образом, эти пациентки относятся к группе повышенного риска по развитию тромбоэмболических осложнений. Так, высокая частота мутаций FV Leiden, протромбина G20210А, MTHFR C677T была с более высокой частотой выявлена у женщин с тремя и более неудачами ЭКО по сравнению с женщинами, забеременевшими с первой попытки, или женщинами, у которых беременность наступила спонтанно [10]. Таким образом, пациенты из этой группы могут быть подвержены значительно более высокому риску развития тромбоэмболических осложнений. У таких женщин мы настоятельно рекомендуем проводить обследование на наличие наследственных и приобретенных форм гемостаза. Это позволяет нам уже на этапе фертильных циклов начать патогенетически обоснованную профилактику с применением низкомолекулярного гепарина, обеспечивающую создание оптимальных условий для имплантации и профилактику тромботических осложнений. Особое внимание следует обратить на высокую частоту антифосфолипидного синдрома у пациенток, включенных в программы вспомогательных репродуктивных технологий, которая составляет 10-48% по сравнению с 1-5% в общей популяции [1]. У таких пациенток повышен риск неудач ЭКО, нарушений имплантации и тромбоэмболических осложнений. Наличие генетических форм тромбофилий, особенно их сочетание с антифосфолипидным синдромом, однонаправленность действия различных форм тромбофилии могут быть причиной клинически не диагностированных ранних преэмбрионических потерь. Антифосфолипидные антитела повышают экспрессию ингибитора активатора плазминогена 1 (PAI-1) и тканевого фактора, что усиливает протромботические механизмы и снижает активность фибринолиза, приводя к дефектам имплантации и снижению глубины децидуальной инвазии трофобласта.
Если считать тромбофилию постоянно персистирующим фактором у женщин с генетической тромбофилией или АФС, то первые ее эффекты представляются как дефекты имплантации плодного яйца, недостаточная глубина инвазии трофобласта, неполноценная плацентация и, как следствие, эндотелиопатия. Предполагается возможная этиологическая роль АФА в генезе бесплодия и привычного выкидыша, препятствующих развитию цитотрофобласта в синцитиотрофобласт на ранних сроках беременности. С нашей точки зрения, новая эра в понимании этиологии и патогенеза бесплодия и неудач ЭКО (в том числе преэмбрионических потерь беременности - после ЭКО) началась с открытия новых наиболее часто встречающихся в общей популяции генетических дефектов гемостаза тромбофилического характера и АФС, а также с установления роли тромбофилии в патологии процессов имплантации плодного яйца, плацентации и более поздних нарушениях маточно-плацентарной перфузии. В процессе подготовки к имплантации под влиянием прогестерона в эндометрии происходит повышение содержания PAI-1, тканевого фактора и снижение уровня активаторов плазминогена тканевого и урокиназного типов, металлопротеаз матрикса и вазоконстриктора - эндотелина 1. Эти физиологические механизмы регуляции гемостаза, фибринолиза, экстрацеллюлярного матрикса и сосудистого тонуса направлены на предотвращение образования геморрагии при дальнейшей инвазии трофобласта. Со своей стороны бластоциста синтезирует активаторы плазминогена тканевого и урокиназного типов и протеазы, которые необходимы для разрушения экстрацеллюлярного матрикса в процессе имплантации. Их излишний синтез в свою очередь регулируется хорионическим гонадотропином. В процессе «дозированного» разрушения матрикса под действием ферментов, выделяемых бластоцистой, клетки эндометрия, которые содержат определенное количество экстраваскулярного фибрина, не фагоцитируются, а как бы «отодвигаются» посредством «контактного ингибирования». Эта фаза процесса имплантации носит название «аваскулярной», или «гистиотрофной». Следует отметить, что это наиболее уязвимая фаза имплантации: часто такие факторы, как вирусы, токсины, антитела и пр., могут непосредственно влиять на полноценность имплантации. С точки зрения влияния тромбофилии наиболее ярким примером являются полиморфизм-1 и другие генетически обусловленные дефекты фибринолиза с повышением уровня PAI-1, гиперфибриногенемией и АФА. Так, согласно нашим данным, тромбофилия как сложный интегральный (с нашей точки зрения, и инициальный) фактор неудачи ЭКО была обнаружена у 90% пациенток с неудачами ЭКО в анамнезе [11]. Таким образом, подготовка к ЭКО женщин с бесплодием и тромбофилией требует особого похода.
В большинстве случаев возникновение тромбозов связано с синдромом гиперстимуляции яичников (СГЯ), поэтому этому серьезному осложнению мы решили посвятить отдельный раздел.
Синдром гиперстимуляции яичников
СГЯ является жизнеугрожающим состоянием, симптомы которого колеблются от легкого недомогания до развития ОРДС, почечной недостаточности и тромбозов. При ЭКО СГЯ развивается у 1-10% женщин. Тромбоэмболические осложнения при СГЯ развивается в 0,04% случаев [12].
Факторами риска развития СГЯ являются молодой возраст пациентки, низкий вес, наличие синдрома поликистозных яичников. Считается, что у женщин молодого возраста плотность рецепторов гонадотропинов больше, следовательно, больше и чувствительность к ним. У пациентов к СГЯ с достоверно большей частотой выявляются атопии по сравнению с контрольной группы [13]. Возможно, нарушение иммунологических механизмов приводит к развитию гиперчувствительности и воспалительного ответа даже в ответ на неспецифические стимуляторы. Риск развития СГЯ во многом определяется видом программы ЭКО. Риск СГЯ больше при применении агонистов гонадолиберин-рилизинг гормона, чем при применении его антагонистов [14]. Еще меньше риск развития СГЯ при применении кломифена цитрата или менопаузального хорионического гонадотропина. Факторами риска СГЯ также является стремительное увеличение уровня эстрадиола в плазме крови (>2500 пг/мл), появление множества фолликулов среднего размера по данным ультразвукового исследования. Кроме того, если в результате ЭКО наступает беременность, начинается дополнительная выработка эндогенного ХГЧ, что увеличивает риск развития СГЯ. Факторы риска развития СГЯ суммированы в табл. 2.
Таблица 2.
Факторы риска развития СГЯ
| Характеристика пациентки:
Молодой возраст (<30 лет) Низкая масса тела СГЯ в анамнезе Сидром поликистозных яичников Использование высоких доз гонадотропинов для стимуляции овуляции Применение ХГЧ, а не прогестерона для поддержки лютеиновой фазы Большое количество антральных в яичнике, по данным УЗИ, до начала стимуляции овуляции Быстрый рост концентрации эстрадиола (>2500 пг/мл) Большое число полученных ооцитов (>20) Наступление беременности |
Описаны семейные случаи СГЯ, в том числе и рецидивов этого синдрома и его развитие во время беременности у родственников. Это может свидетельствовать о наличии наследственных признаков, определяющих повышенный риск развития этого синдрома. Так, сообщается об обнаружении у пациенток с СГЯ полиморфизма рецепторов ФСГ, которые определяют повышенную чувствительность рецепторов к этому гормону [12].
Патогенез СГЯ
Репродуктивные технологии включают применение антагонистов или агонистов гонадолиберин-рилизинг гормона для стимуляции яичников и человеческого хорионического гонадотропина (ХГЧ) для индукции овуляции. Стимуляция яичников может приводить к их избыточной активации и развитию СГЯ. Развитие этого синдрома связывают с применением экзогенного ХГЧ. Крайне редко СГЯ может возникать при самопроизвольной беременности (чаще в условиях, когда наблюдается повышенная продукция ХГЧ, например, при многоплодной беременности), а также при стимуляции овуляции кломифеном цитратом [8]. Основным характерным признаком, обнаруживающимся при СГЯ, является двустороннее увеличение яичников за счет множественных кист. При морфологическом исследовании в таких яичниках выявляются многочисленные желтые тела, фолликулярные кисты и выраженный отек овариальной стромы. Образование кист в яичниках при СГЯ предположительно связано с непосредственным влиянием стимуляции гонадотропинами, так как сходные изменения в яичниках наблюдаются и при других состояниях, сопровождающихся повышенными уровнями эндогенных гонадотропинов, например, при пузырном заносе, хорионкарциноме и многоплодной беременности.
Патогенез СГЯ пока еще мало изучен. Предполагается, что при СГЯ происходит выброс из яичника вазоактивных субстанций (цитокины, ангиотензин, эндотелиальный сосудистый фактор роста). Это приводит к повышению проницаемости сосудов и выходу белков и жидкости в интерстициальное пространство. В результате развивается асцит, гидроторакс, анасарка, гемоконцентрация и тромбоэмболические осложнения. При СГЯ происходит падение артериального давление, увеличение сердечного выброса, активация ренин-ангиотензин-альдостероновой и симпатоадреналовой системы.
Весьма интересна история развития представлений о патогенезе СГЯ. Впервые подтверждения того, что основным механизмом патогенеза СГЯ является повышение проницаемости капилляров, выло показано в экспериментах на кроликах с использованием внутривенного красителя [15]. При этом основным условием для перехода жидкости из внутрисосудистого пространства в брюшную полость было наличие яичников. СГЯ в экспериментах не удалось индуцировать ни у животных мужского пола, ни у мужчин. Эти эксперименты легли в основу концепции о том, что ключевым фактором для развития СГЯ является наличие яичников, которые секретируют вазоактивный медиатор. Кроме того, позднее при СГЯ был выявлен феномен активации ангиогенеза. В дальнейшем многочисленные эксперименты были направлены на то, чтобы установить этот медиатор, выделяемый яичниками и повышающий проницаемость сосудов. Исходно внимание ученых было обращено к изучению эстрогенов, прогестнинов и пролактина в качестве медиаторов СГЯ, однако прямое патогенетическое значение этих субстанций для развития СГЯ выявить не удалось. Так, развитие асцита у кроликов женского пола не было связано с высокими дозами эстрогенов и прогестерона [7]. Таким образом, повышенный уровень эстрадиола служит маркером ответа яичников на стимуляцию, но не является причиной для возникновения СГЯ.
Доказанным фактом является то, что ренин-ангиотензин-альдостероновая система (РААС) принимает активное участие в механизмах развития СГЯ. С одной стороны, яичники секретируют некоторые компоненты РААС, с другой, на функционирование РААС оказывает непосредственное влияние ХГЧ, который напрямую ассоциирован с СГЯ. Также была подтверждена системная активация РААС в условиях гемодинамических сдвигов у пациенток с СГЯ. Однако остается неясным, могут ли компоненты РААС быть основным патогенетическим звеном СГЯ или эта система активируется вторично в качестве ответа организма на гиповолемию в условиях СГЯ,
Патофизиологические изменения, происходящие в условиях СГЯ, напоминают агрессивно развивающийся системный воспалительный ответ. Однако данные о роли цитокинов в патогенезе СГЯ весьма противоречивы. Эти низкомолекулярные протеины проявляют свою активность в крайне низких концентрациях и реализуют свои эффекты при помощи аутокринных, паракринных и эндокринных механизмов. На активность цитокинов оказывает влияние функциональный статус цитокиновых рецепторов, наличие ингибиторов цитокинов, растворимых рецепторов и связывающих белков. Тем не менее большинство исследований в этой области указывает на повышение уровней медиаторов ранней фазы воспаления (ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-18, ИЛ-18, TNF-альфа и сосудистого эндотелиального фактора роста) и на одновременное снижение уровней иммуносупрессивных и противовоспалительных цитокинов (ИЛ-10) на ранних стадиях развития СГЯ. Существует гипотеза о врожденных дефектах иммунного ответа, обуславливающих повышенный риск СГЯ. Растворимая молекула адгезии клеток сосудов-1 (sVCAM-1) и растворимая молекула межклеточной адгезии-1 (sICAM-1), которые принадлежат к суперсемейству иммуноглобулинов и являются основными медиаторами адгезии лейкоцитов, их взаимодействий с сосудистой стенкой и экстравазации в процессе иммунных и воспалительных реакций, также могут участвовать в патогенезе СГЯ. Это предположение было доказано в одном из исследований по типу случай-контроль по оценке уровней sICAM-1 и sVCAM-1 в перитонеальной жидкости и в плазме крови [16]. Еще в одном исследовании в сыворотке крови и в асцитической жидкости у пациенток с СГЯ были выявлены более высокие уровни sICAM-1 и более низкие уровни растворимого Е-селектина - еще одной молекулы, контролирующей эндотелиальную адгезию [16]. Конкретные механизмы участия этих медиаторов в патогенезе СГЯ еще предстоит установить, однако на данном этапе ясно, что они имеют значение для регуляции сосудистой проницаемости.
Повышение сосудистой проницаемости с последующим развитием асцита при СГЯ связано с субстанциями, накапливающимися в фолликулярной жидкости. Одним из важнейших таких факторов, принимающих участие в патогенезе СГЯ, предположительно является VEGF. Существует несколько доказательств этой гипотезы. Во-первых, уровни VEGF в фолликулярной жидкости превышают таковые в плазме крови. Во-вторых, во время овуляции регистрируется повышение концентрации VEGF в крови. Кроме того, введение ХГЧ стимулирует экспрессию мРНК VEGF лютеинизирующимися клетками гранулезы яичников [17], что объясняет, почему введение ХГЧ часто является критическим фактором для развития СГЯ. Повышенные уровни VEGFв плазме крови и перитонеальной жидкости были выявлены у пациенток с СГЯ по сравнению с контрольной группой [18]. Усиленная экспрессия мРНК VEGF была описана у пациенток с синдромом поликистозных яичников, для которых характерен повышенный риск развития СГЯ. Тем не менее конкретные патогенетические механизмы, посредством которых VEGF обуславливает развитие СГЯ, остаются не до конца известными.
Большой вклад в изучение роли VEGF в патогенезе СГЯ внес Rizk и соавт. (1997) [19]. VEGF представляет собой член семейства гепарин-связывающих протеинов, который непосредственно воздействуют на эндотелиальные клетки и индуцирует процессы пролиферации и ангиогенеза. VEGF кодируется общим геном с фактором сосудистой проницаемости (VPF), которые способствует экстравазации белков в сосудах злокачественных опухолей. В результате транскрипции этого гена при участии альтернативного сплайсинга получаются несколько изоформ VEGF. Семейство VEGF включает четыре разных димерных формы (A-D) и плацентарный фактор роста. Все члены семейства VEGF связываются с тремя рецепторами (VEGF-R 1-3), которые экспрессируются на эндотелиальных клетках. Было идентифицировано и клонировано два рецептора VEGF (VEGFR-1 и VEGFR-2), которые относятся к семейству тирозинкиназных рецепторов. VEGFR-1 экспрессируется на эндотелиальных клетках, клетках трофобласта, моноцитах и мезангиальных клетках в почках. VEGFR-2 также экспрессируется на гемопоэтических стволовых клетках и мегакариоцитах. Экспрессия VEGF стимулируется под действием гипоксии, а также цитокинами и простагландинами. Таким образом, цитокины и факторы роста, непосредственно не стимулирующие ангиогенез, могут модулировать процессы ангиогенеза путем влияния на экспрессию VEGF. Иными словами цитокины могут оказывать непрямой ангиогенный и антиангиогенный эффект. Продукцию VEGF стимулирует трансформирующий фактор роста бета, фактор роста фибробластов-4, фактор роста тромбоцитарного происхождения, инсулиноподобный фактор роста, интерлейкин-1бета и интерлейкин-6, тогда как тромбоспондин и интерлейкин-10 подавляют экспрессию VEGF. VEGF синтезируется и депонируется в гранулах Т-лимфоцитов, тучных клеток, нейтрофилов и мегакариоцитов. VEGF-А или собственно VEGF существует минимум в 5 изоформах, имеющих разную молекулярную массу. Главное, что отличает эти изоформы друг от друга, это способность к связыванию гепарина и гепарин-сульфата.
InvivoVEGF является мощным медиатором сосудистой проницаемости. Он также принимает непосредственное участие в инициации и поддержании ангиогенеза на различных этапах эмбриогенеза, а также в тканях взрослого организма, для которых характерны интенсивные процессы новообразования сосудов, например, в ткани эндометрия и лютеинизирующихся фолликулах. Помимо своей физиологической роли VEGF выполняет свои функции и в условиях патологии, являясь критически важным фактором ангиогенеза при становлении васкуляризации опухолей. Повышенные уровни VEGF также выявляются в перитонеальной жидкости в условиях эндометриоза. VEGF может играть важную роль в регуляции циклических процессов ангиогенеза в яичниках, а его способность повышать сосудистую проницаемость может служить важным фактором для обеспечения продукции секрета маточных труб и появления фолликулярной жидкости, а также жидкости в доброкачественных опухолях яичника, имеющих эпителиальную выстилку, которая содержит VEGF. GordonJD и соавт. (1996) показали, что VEGF в здоровых яичниках локализуется в слое тека-клеток, тогда как содержание этого белка в клетках гранулезы минимальное. VEGF не экспрессируется в атрезирующихся фолликулах и дегенерирующем желтом теле [20]. В то же время высокий уровень VEGF обнаруживается в хорошо васкуляризованном желтом теле. В постменопаузе в яичниках VEGF в норме не выявляется и обнаруживается только в инклюзионных эпителиальных кистах и серозных цистаденомах. На основании этих экспериментальных данных авторы сделали вывод о том, что в течение репродуктивного периода VEGF играет важную роль для процессов роста и поддержания функции фолликулов и желтых тел в яичнике, что осуществляется на уровне модуляции ангиогенеза.
Молекулярно-биологические исследования свидетельствуют о четкой взаимосвязи между VEGF и ХГЧ [19]. Было показано, что экспрессия мРНК VEGF у крыс и в яичниках приматов происходит преимущественно после пика ЛГ. Этот пик ЛГ также является ключевым фактором и для развития СГЯ. Кроме того, использование антагониста ГнРГ в лютеиновую фазу с целью подавления выброса ЛГ приводит к торможению экспрессии мРНК VEGF. Отсюда ясно, почему использование прогестерона для поддержки лютеиновой фазы снижает вероятность развития СГЯ по сравнению с ХГЧ. Экспрессия VEGF под влиянием ХГЧ в яичниках осуществляется в клетках гранулезы и зависит от его дозы. Активность VEGF нарастает в процессе роста граафова фолликула и достигает пика при формировании желтого тела [21]. Было показано, что именно повышенная суммарная продукция VEGF на уровне фолликулов обуславливает нарастание уровней VEGF в плазме крови, что ассоциируется с развитием СГЯ [22].
Фактор фон Виллебранда (vWF) считается маркером активации эндотелиальных клеток. Его концентрация повышается в условиях избыточной экспрессии VEGF эндотелиальными клетками. Было показано, что повышенные уровни vWF в день переноса эмбрионов коррелируют с тяжестью СГЯ, а повышение уровней vWF предшествует развитию тяжелого СГЯ [23]. Однако такого повышения уровней vWF не было зарегистрировано в фолликулярной жидкости, что указывает на то, что повышенные уровни vWF не могут быть яичникового происхождения. По всей видимости, источником vWF при СГЯ является эндотелий, а на выброс vWF оказывают вазоактивные медиаторы овариального происхождения. У пациенток с СГЯ по сравнению с женщинами с высоким ответом на стимуляцию было выявлено более выраженное повышение уровней vWF за день до забора ооцитов, причем повышенные уровни vWF сохранялись в условиях СГЯ в течение всей лютеиновой фазы, тога как у пациенток без СГЯ уровни vWF прогрессивно снижались после забора ооцитов [24]. Снижение уровней vWF при СГЯ сопровождает клиническое улучшение. Таким образом, в клинической практике повышенные уровни vWF можно рассматривать в качестве прогностических для развития СГЯ и в качестве дискриминаторного параметра. Однако vWF предположительно играет роль в генезе формирования патологического каскада реакций в условиях СГЯ в качестве вторичного медиатора, который выделяется эндотелиальными клетками в ответ на их стимуляцию фактором яичникового происхождения.
Вазоконстриктор эндотелин-1 является еще одном фактором, повышающим сосудистую проницаемость. При СГЯ его концентрация в фолликулярной жидкости в 100-300 раз превышает таковую в плазме крови. У пациенток с СГЯ выявляется повышение плазменных уровней эндотелина-1, однако его концентрации нарастают параллельно с содержанием в крови других нейрогуморальных вазоактивных факторов и коррелируют с тяжестью СГЯ [25], что может говорить о том, что повышение уровней эндотелин-1 является частью ответа организма, направленного на сохранение гомеостаза, а не инициирующим фактором в развитии СГЯ.
Роль эндотелия в патогенезе СГЯ. Впервые роль эндотелия в патогенезе СГЯ была показана в элегантном исследовании Albert С. и соавт. (2002) [18]. В основу этой гипотезы легли более ранние наблюдения о более высоком уровне VEGF в плазме крови по сравнению с фолликулярной жидкостью у женщин из группы риска развития СГЯ [26]. Это свидетельствует о том, что другие клетки помимо фолликулярных могут быть источником и мишенями для VEGF. Для тестирования этой гипотезы Albert С. и соавт. создали invitro модель, в которой проверяли воздействие эстадиола и ХГЧ на человеческий микрососудистый эндотелий с целью оценки способности эндотелиальных клеток к экспрессии и секреции медиаторов, которые могут быть вовлечены в патогенез СГЯ [18]. В результате этих экспериментов было показано, что эндотелий является источником VEGF и ИЛ-6. Эти медиаторы могут реализовывать свое воздействие на паракринном и аутокринном уровне, индуцируя изменения в сосудах, связанные с СГЯ, Рецепторы к VEGF и ИЛ-6 были обнаружены в клетках желтого тела. Кроме того, была установлена роль этих рецепторов для повышения сосудистой проницаемости у человека [27]. Albert С. и соавт. в своем исследовании установили, что ХГЧ индуцирует экспрессию KDR в эндотелиальных клетках человека - наиболее функционального рецептора VEGF, который регулирует митогенез, ангиогенез и процессы перестройки цитоскелета [18]. Эта усиленная экспрессия рецептора KDR, по всей видимости, и является ключевой причиной для резкого увеличения проницаемости сосудов в условиях СГЯ. Схематично патогенетическая роль эндотелия в условиях СГЯ отображена на рис. 1. Непрерывность архитектоники цитоскелета в эндотелиальных клетках является важным фактором сохранения функций эндотелиального барьера. Проницаемость эндотелия для воды и солей зависит от формы и конфигурации эндотелиоцитов. Эта же группа ученых выявила нарушение регулярности эндотелиального слоя, перестройку активных филаментов и морфологические изменения в эндотелиоцитах под действием ХГЧ. В то же время сам по себе эстрадиол не способен индуцировать экспрессию рецепторов VEGF и не повышает сосудистую проницаемость. Таким образом, блокада VEGF или его рецептора с использованием, например, специфических антител, может быть привлекательной мишенью для разработки новых методов для профилактики и лечения СГЯ.
Рисунок 1.
Роль эндотелиальных клеток в патогенезе СГЯ

VEGF- сосудистый эндотелиальный фактор роста, KDR- рецептор VEGF, ИЛ-6 - интерлейкин-6, ХГЧ - хорионический гонадотропин человека
Таким образом, основную гипотезу развития СГЯ в настоящее время можно представить следующим образом (рис. 2). В условиях СГЯ происходит нарушение регуляции процесса овуляции, что сопровождается гиперпродукцией провоспалительных факторов в яичниках. В результате происходит вторичное увеличение проницаемости капилляров и переход воспалительных медиаторов в другие компартменты. При наиболее тяжелых формах СГЯ этот процесс сопровождается системными проявлениями.
Рисунок 2.
Патофизиология СГЯ

sVCAM-1 - растворимая молекула сосудистой адгезии-1, TNF- фактор некроза опухолей,VEGF- сосудистый эндотелиальный фактор роста,VEGFR-1 - рецептор сосудистого эндотелиального фактора роста, vWF- фактор фон Виллебранда
Классификация СГЯ была предложена RabauE. в 1967 году. Он выделял три клинических категории СГЯ (легкий, средней тяжести, тяжелый) и шесть степеней тяжести, выделенных на основании клинических и лабораторных признаков. В дальнейшем эта классификация была модифицирована MathurR и соавт. (2007) [28]:
Таблица 3.
Классификация СГЯ
| Легкий СГЯ | вздутие живота
слабо выраженная боль в животе увеличение яичников до <8 см |
| СГЯ средней тяжести | умеренно выраженная боль в животе
тошнота +/- рвота увеличение яичников до 8-12 см наличие признаков асцита по данным УЗИ |
| СГЯ тяжелой степени | клинически выраженный асцит (в ряде случаев плевральный выпот)
олигурия гемоконцентрация (гематокрит >45%) гипопротеинемия увеличение яичников >12 см |
| Критический СГЯ | напряженный асцит или массивный плевральный выпот
гемоконцентрация (гематокрит >55%) лейкоцитоз >25000 олигурия/анурия тромбоэмболические осложнения острый респираторный дистресс-синдром |
Критериями тяжести СГЯ является нарушение функции печени, гемоконцентрация, лейкоцитоз, почечная недостаточность, анасарка. Выделяют также жизнеугрожающий или критический СГЯ, который включает в себя увеличение размера яичников, развитие острого респираторного дистресс-синдрома, напряженного асцита, гидроторакса, анасарки, перикардиального выпота, тяжелой почечной недостаточности и тромбоэмболические осложнения. Критерии тяжести СГЯ суммированы в табл. 4.
Таблица 4.
Критерии тяжести СГЯ
| Тяжелый СГЯ | Жизнеугрожающий СГЯ |
| Увеличения размера яичников
Асцит, гидроторакс, анасарка Гематокрит >45% Лейкоцитоз >15 000 Олигурия Креатинин до 1,6 мг/дл Скорость клубочковой фильтрации >50 мл/мин Дисфункция печени |
Увеличения размера яичников
Напряженный асцит, гидроторакс, анасарка Гематокрит >55% Лейкоцитоз >25 000 Креатинин >1,6 мг/мл Скорость клубочковой фильтрации <50 мл/мин Тромбоэмболические осложнения Острый респираторный дистресс-синдром |
СГЯ обычно развивается примерно через 20 дней (в период от 5 до 45 дней) после индукции овуляции [19]. Выделяют раннее начало синдрома - через 3-5 дней назначения овуляторных доз ХГЧ, и позднее начало СГЯ. Последнее бывает обусловлено нарастанием ХГЧ в условиях наступившей беременности и клинически является более тяжелой формой.
Клинические проявления СГЯ
СГЯ является тяжелым осложнением стимуляции овуляции, которое может привести в том числе и к фатальному исходу. С момента внедрения гонадотропинов в клиническую практику для индукции овуляцию был зарегистрирован целый ряд смертельных случаев, косвенно или напрямую связанных с СГЯ. Впервые летальный случай был описан в 1951 году Gotzsche, который сообщил о фатальном артериальном тромбозе - тотальной окклюзии левой внутренней сонной артерии у 37-летней пациентки с бесплодием, получавшей терапию гонадотропином. В последующем были описаны и другие летальные случаи, связанные с СГЯ, когда причиной смерти была массивная тромбоэмболия и ишемический инсульт (Mozws, 1965, Cluroe 1995). Таким образом, тромбозы и эмболии можно рассматривать как наиболее тяжелые осложнения СГЯ, которые могут привести к летальному исходу, инвалидизации вследствие инсульта и ампутации конечностей.
Массивный переход жидкости в интерстициальное пространство характеризуется развитием асцита, гидроторакса, перикардиального выпота, электролитными нарушениями, олигурией, гемоконцентрацией, гиповолемическим шоком. Первым проявлением СГЯ обычно бывают дискомфорт в животе, тошнота, рвота, диарея. Развитие диареи и рвоты, возникновение одышки, одышки, асцита в течение первых 48 часов после назначения ХГЧ свидетельствуют о тяжелом течении заболевания. При физикальном обследовании обнаруживается прибавка массы тела, увеличение объема живота, симптомы гиповолемии. Через брюшную стенку пальпируются увеличенные яичники. Особое внимание следует уделить осмотру конечностей и шеи, чтобы не пропустить тромбоз.
Данные лабораторных исследований свидетельствуют об электролитных нарушениях (гиперкалиемия и гипонатриемия), гемоконцентрации, гипоальбуминемии, повышении уровня креатинина. Примерно у 30% пациенток выявляются нарушения функции печени (умеренная гиперферментемия). При СГЯ вследствие перехода плазмы крови в экстравазальное пространство происходит значительное снижение уровня IgG и IgA в плазме крови, что делает пациентов с СГЯ чувствительными к развитию инфекционных осложнений. При анализе асцитической жидкости выявляется высокая концентрация белка, низкое содержание лейкоцитов и высокий уровень эритроцитов. При ультразвуковом исследовании выявляются множественные фолликулярные кисты и асцит.
Причиной развития дыхательной недостаточности при СГЯ могут служить компрессия легких вследствие асцита, плеврита, перикардиального выпота, развития ОРДС, тромбоэмболии, отека легких, ателектаза, внутриальвеолярных кровоизлияний. В большинстве случаев плевральный выпот развивается с двух сторон и наблюдается одновременно с асцитом. Однако описаны случаи возникновения одностороннего плеврального выпота в качестве единственного симптома СГЯ. Односторонний выпот чаще развивается с правой стороны.
Интересно, что если при спонтанно наступившей беременности тромбозы затрагивают преимущественно (в 70% случаев) глубокие вены нижних конечной (илиофеморальный сегмент), то тромбозы, возникающие вследствие индукции овуляции, локализуются в основном в венах верхней части тела. Хотя увеличение размеров яичников при СГЯ, казалось бы, способствует стазу крови в тазовых венах и венах нижних конечностей. В большинстве случаев (60%) тромбозы, связанные с ЭКО, развиваются в яремной вене, подключичной, подмышечной венах, а также венах головного мозга. Последнее является наиболее тяжелым осложнением. Летальность при тромбозе церебральных вен достигает 5-30%, при этом более опасны тромбозы синусов головного мозга. Интересно, что исход тромбозов церебральных вен у беременных и в послеродовом периоде более благоприятный, чем при церебральных тромбозах, не связанных с беременностью. Полное выздоровление, по данным анализа OuY. и соавт. (2003), наблюдалось у 49% женщин с церебральными тромбозами и у 79% с тромбозами других локализаций [12]. В большинстве случаев развиваются венозные тромбозы, однако у 25% пациентов могут иметь место и артериальные тромбозы (в основном инсульты). В 75% тромбозы развиваются у пациенток с наступившей беременностью, у 66% выявляется СГЯ [12].
По данным KodamaH. и соавт. (1996), маркеры активации коагуляции и фибринолиза (ТАТ, РАР) остаются повышенными после индукции овуляции на протяжении 3-4 недель у женщин с наступившей беременностью [4]. Поэтому развитие тромбоэмболических осложнений возможно и после купирования симптомов СГЯ. В течение первых двух дней после стимуляции овуляции активируется коагуляционный каскад и лишь потом фибринолитическая система. Ранняя активация коагуляции, возможно, является причиной развития субклинических тромбозов. Вероятно, меньший диаметр церебральных сосудов объясняет более раннее развитие клинических проявлений при тромбозах данной локализации (в среднем через 10 дней после стимуляции овуляции). Множественные тромбозы мелких сосудов мозга могут протекать практически бессимптомно или проявляться в виде стертой неврологической симптоматики [29], кроме того, при аутопсии выявляются множественные тромбозы с вовлечением сосудов мозга различного диаметра [30].
Возникновение тромбозов связывают с повышением уровня эстрадиола в крови, гемоконцентрацией и гиповолемией. При повышении уровня эстрогенов возрастает содержание тромбоцитов, фибриногена, vWF и снижается уровень ATIII. Вследствие гемоконцентрации увеличивается вязкость крови и концентрации факторов коагуляции.
Тромбоэмболические осложнения при СГЯ чаще развиваются у пациенток с генетическими формами тромбофилии (дефицит протеинов С, S, ATIII) [12]. Поэтому расширенное исследование системы гемостаза с определением генетических форм тромбофилии и маркеров АФС у пациенток с СГЯ мы считаем обязательным.
Лечение СГЯ
Специфическое лечение СГЯ отсутствует, и терапия сводится в основном к симптоматической. Симптомы СГЯ обычно проходят самостоятельно с уменьшением уровня ХГЧ (в течение 7 дней у небеременных и в течение 10-20 дней у беременных пациенток). Пациенткам требуется полный покой и строгий постельный режим в течение 2-3 недель.
Ежедневно требуется контроль массы тела, диуреза. Рекомендуется выпивать в день более 1 литра жидкости, содержащей электролиты. При среднетяжелом и тяжелом СГЯ следует избегать проведения влагалищного обследования в связи с риском разрыва киста яичника и развития кровотечения. Требуется ежедневный контроль креатинина, электролитов, гематокрита, гемоглобина, клеточного состава крови, печеночных ферментов, коагулограммы, по возможности - бета-ХГЧ [37]. Желательно установить подключичный катетер, что связано с меньшим риском развития тромботических осложнений, чем наличие периферического катетера. При развитии дыхательной недостаточности при отсутствии плеврального выпота или при сомнительных результатах рентгенографии легких требуется исключение ТЭЛА (КТ, вентиляционно-перфузионная сцинтиграфия). Обязательным компонентом лечения является инфузионная терапия. Ее задачами является восстановление ОЦК, ликвидация гемоконцентрации, борьба с почечной недостаточностью. Предпочтительно вводить физиологический раствор и глюкозу. Восстановление электролитного баланса, повышение осмотического давления крови способствует переходу жидкости из внеклеточных пространств обратно в сосудистое русло. При выраженной гиповолемии, гемоконцентрации (гематокрит >45%), гипоальбуминемии (<3 г/дл) рекомендуется применение альбумина и/или свежезамороженной плазмы, которая позволяет также коррегировать показатели системы гемостаза. Важно отметить, что применение диуретиков в условиях гиповолемии и гемоконцентрации, а также их передозировка увеличивают риск развития тромбоэмболических осложнений.
При плевральном выпоте обычно проводится консервативное лечение. Плевральная функция показана при прогрессировании дыхательной недостаточности. Асцит также рекомендуется вести консервативно. Показаниями к парацентезу является напряженный асцит, почечная недостаточность, резистентная к консервативной терапии. Парацентез проводится трансабдоминально или трансвагинально под контролем УЗИ, что позволяет снизить риск повреждения увеличенных яичников. Восстановление функции почек после парацентеза связывают с восстановлением перфузии почек, венозного оттока, нормализацией сердечного выброса. У пациенток с тяжелым СГЯ нередко приходится выполнять парацентез 2-3 раза в неделю. Abuzeid М. и соавт. (2003) предложили применять у таких пациенток постоянный катетер по типу хвоста свиньи [31]. Также при тяжелом СГЯ было предложено наложение перитонеально-венозных шунтов, что позволяет возвращать перитонеальную жидкость в сосудистое русло. При этом удается восполнить потери иммуноглобулинов [12].
В связи с повышенным риском развития инфекционных осложнений у пациенток c СГЯ целесообразным является профилактическое назначение антибиотиков. Риск инфекционных осложнений можно снизить, применяя инвазивные процедуры (лапарацентез, плевральную пункцию) строго по показаниям. Следует отметить, что в 50% случае AbramovY. и соавт. (1998) не выявили возбудителей у пациенток с признаками развития сепсиса [32]. Это может быть связно с тем, что само течение СГЯ является проявлением синдрома системного воспалительного ответа, связанного с массивным выбросом цитокинов и играющего ведущую роль в развитии состояния гиперкоагуляции.
Обязательным является профилактическое назначение антикоагулянтов под контролем маркеров тромбофилии (D-димер) [38]. Препаратом первого выбора для лечения тромботических осложнений СГЯ является НМГ. НМГ должны назначаться всем пациенткам, находящимся на стационарном лечении по поводу СГЯ. При стойкой тяжелой неврологической симптоматике, тромбозе венозных синусов возможно проведение прицельного тромболизиса и тробэктомии. Целесообразно проводить скрининг на наличие генетических форм тромбофилии и АФС, особенно у женщин с тромботическими осложнениями, а также профилактическое применение НМГ у таких пациенток. Важно обеспечить адекватную инфузионную терапию для снижения гемоконцентрации.
По последним данные, учитывая патогенез СГЯ с развитием гиперкоагуляции, воспаления, ДВС-синдрома, возможным эффективным методом терапии может быть применение рекомбинантного активированного протеина С, который уже доказал свою эффективность при тяжелом сепсисе [33]. Однако эта гипотеза требует дальнейших подтверждений.
Сообщается также о новых подходах к лечению СГЯ, которые основаны пока преимущественно на данных экспериментальных исследований на животных. Для терапии СГЯ, в частности, предается применять индометацин, блокирующий синтез простагландинов, которые могут быть одним из патогенетических факторов развития СГЯ. Однако в ретроспективном исследовании BorensteinR. и соавт. (1989) преимуществ использования индометацина показано не было [34]. Более того, в настоящее время применение нестероидных противовоспалительных препаратов при СГЯ не рекомендуется, так как они могут оказывать неблагоприятное влияние на процессы имплантации и усугубить развивающиеся в условиях тяжелого СГЯ нарушения функции почек [35]. Одной из теорий патогенеза СГЯ является выброс гистамина и гистаминоподобных субстанций из яичника. Отчасти эту теорию подтверждает тот факт, что аллергии являются фактором риска развития СГЯ. В исследованиях на животных антигистаминные препараты были эффективными для предотвращения развития СГЯ [36], однако для подтверждения этих предположений требуются проспективные исследования с участием человека.
Резекция яичников при СГЯ категорически противопоказана. Хирургической вмешательство, предпочтительно лапароскопическое, необходимо только при разрыве кисты яичника, перекруте кисты, кровотечении. Перекрут кисты яичника следует заподозрить при появлении болей в нижнем отделе живота и обнаружении уплотненного болезненного образования при пальпации. Снижение гематокрита может быть связано с восстановлением ОЦК, однако прежде всего при этом следует исключать развитие кровотечения.
Редко при неэффективности консервативного лечения при тяжелом течении СГЯ для снижения уровня ХГЧ требуется прерывание беременности.
Профилактика СГЯ включаетвведение ХГЧ только при приемлемом уровне эстрадиола, применение прогестерона, а не ХГЧ в лютеиновую фазу. Кроме того, нами была разработана схема профилактики тромбоэмболических осложнений при подготовки и проведении программ вспомогательных репродуктивных технологий.
Рекомендации по профилактике тромбозов у пациенток, включенных в программы ЭКО
При планировании ЭКО к выбору профилактики венозных тромбоэмболических осложнений следует подходить индивидуально, взвешивая все факторы риска. Особое внимание необходимо уделить оценке состояния системы гемостаза, включая наследственные и приобретенные формы тромбофилии. Согласно международным рекомендациям (табл. 5) введение НМГ следует начинать с утра в день стимуляции овуляции гонадотропинами. Для сведения к минимуму геморрагических осложнений во время забора яйцеклетки в день процедуры НМГ вводить не следует; инъекции НМГ возобновляют на следующий день. В день переноса эмбриона с утра НМГ не вводится. Затем НМГ применяют в профилактических дозах вплоть до подтверждения беременности. В случае наступления беременности профилактическую антикоагулянтную терапию продолжают.
Таблица 5.
Рекомендации по профилактике тромбоэмболических осложнений у женщин, включенных в программы ЭКО
| Клиническая ситуация | Тактика ведения |
| Один эпизод ВТЭ в анамнезе, не связанный с беременностью или приемом оральных контрацептивов), возникший на фоне транзиторных факторов риска и при отсутствии дополнительных факторов риска, например, ожирения | Динамическое наблюдение или профилактические дозы НМГ (эноксапарин 40 мг, фраксипарин 0,3 мл, фрагмин 5000 МЕ один раз в день) +/- компрессионное белье |
| Один идиопатический эпизод ВТЭ в анамнезе или один эпизод ВТЭ в анамнезе при наличии тромбофилии у пациенток, не получающих постоянную антикоагулянтную терапию, или один случай ВТЭ в анамнезе при наличии дополнительных факторов риска (например, ИМТ >35) | Профилактические дозы НМГ (эноксапарин 40 мг, фраксипарин 0,3 мл, далтепарин 5000 МЕ один раз в день) до стимуляции овуляции и в течение всей беременности +/- компрессионное белье. При дефиците антитромбина необходимо назначение более высоких доз НМГ (эноксапарин 0,5 1 мг/кг, далтепарин 50-100 МЕ/кг каждые 12 часов) |
| Более одного эпизода ВТЭ в анамнезе при отсутствии данных о тромбофилии у пациенток, не получающих постоянную антикоагулянтную терапию | Профилактические дозы НМГ до стимуляции овуляции и в течение всей беременности + компрессионное белье |
| Один или более эпизодов ВТЭ в анамнезе у пациенток, получающих постоянную антикоагулянтную терапию (например, при наличии тромбофилии) | Переход с пероральных антикоагулянтов на НМГ (эноксапарин 0,5 1 мг/кг, далтепарин 50-100 МЕ/кг каждые 12 часов) до контролируемой стимуляции овуляции, продолжение применения НМГ в течение всей беременности + компрессионное белье |
| Подтвержденная тромбофилия при отсутствии ВТЭ в анамнезе | Динамическое наблюдение или профилактические дозы НМГ +/- компрессионное белье. Профилактику настоятельно рекомендуется проводить при наличии дефицита антитромбина III, кроме того, лечение в пользу активного ведения следует принять при наличии симптомных ВТЭ в семейном анамнезе и дополнительных факторов риска |
| Наличие факторов риска ВТЭ при отсутствии тромбофилии и ВТЭ в анамнезе | Необходимо проведение индивидуальной оценки риска. При наличии нескольких факторов риска, включая высокий ИМТ, гиподинамию, тяжелые формы гестоза в анамнезе решение следует склонить в пользу активной профилактики: профилактические дозы НМГ +/- компрессионное белье. При высоком ИМТ может потребоваться коррекция дозы НМГ |
| Синдром гиперстимуляции яичников | Профилактические дозы НМГ +/- компрессионное белье. При отсутствии наступления беременности антикоагулянтная терапия может быть закончена после разрешения симптомов. В случае наступления беременности применение НМГ следует продолжить минимум до конца первого триместра. А в дальнейшем в зависимости от показателей системы гемостаза и наличия дополнительных факторов риска ВТЭ |
| Развившаяся ВТЭ | Терапевтические дозы НМГ (например, 1 мг/кг эноксапарина или 90 МЕ/кг далтепарина каждые 12 часов). Антикоагулянтная терапия должна быть продолжена в течение не менее 6 недель после родов |
Нами разработана тактика подготовки к ЭКО и ведения беременности у пациенток с бесплодием и тромбофилией. При подготовке пациенток с бесплодием, с повторными неудачами ЭКО и тромбофилиями к программе ЭКО мы проводим дифференцированную противотромботическая профилактику в зависимости от причины тромбофилии и степени ее выраженности, а также гирудотерапию в течение 1,5 месяца до программы ЭКО. В качестве антитромботической терапии мы используем низкомолекулярный гепарин, начиная с фертильного цикла, а именно в процессе стимуляции овуляции. Терапия отменяется за сутки до планируемой пункции и через 12 ч. после подсадки эмбрионов возобновляется. Также параллельно мы назначаем минидозы аспирина 50-75 мг 1 раз в сутки, начиная с фертильного цикла в зависимости от агрегационной активности тромбоцитов. Всем женщинам назначаются витамины, полиненасыщенную жирную кислоту (омега-3) и антиоксиданты. В случае обнаружения MTHFR C667T обязательно дополнительно назначение фолиевой кислоту (4 мг/сут), а также витамины группы В. Низкомолекулярные гепарина мы применяем на протяжении всей беременности, за сутки до родов (кесарево сечение) препарат отменяется, через 8 ч. терапия возобновляется до 10-го дня послеродового/послеоперационного периода. Контролем эффективности противотромботической терапии служат маркеры тромбинемии и фибринообразования (ТАТ, F1+2, D-димер). Начало программы ЭКО у пациенток с тромбофилией, как наследственной, так и приобретенной, в условиях выраженной активации системы гемостаза и/или повышенных уровней антифосфолипидных антител мы считает противопоказанным до проведения адекватной подготовки к беременности с применением антикоагулянтной терапии и нормализации или улучшения показателей системы гемостаза.
ХГЧ (хорионический гонадотропин) помогает распознать беременность на самых ранних стадиях развития, порой еще до появления первых симптомов беременности. Как интерпретировать результаты анализа, и что, если уровень ХГЧ выше или ниже нормы?
Что такое ХГЧ?
ХГЧ (хорионический гонадотропин) это гормон, который вырабатывается преимущественно во время беременности. Этот гормон также вырабатывается у небеременных женщин и даже у мужчин, но в гораздо меньшем количестве.
О чем говорит уровень ХГЧ?
Высокий уровень ХГЧ, как правило, указывает на наличие беременности. Если женщина не беременна, но ХГЧ у нее повышен, это может говорить о серьезных заболеваниях (рак яичников, рак молочных желез, рак желудка и другие онкологические заболевания).
Как измеряется ХГЧ?
ХГЧ может быть измерен в крови и в моче. Определение ХГЧ в моче это не что иное, как обычный тест на беременность. Тест на беременность не может определить количество ХГЧ, а может лишь сказать, что уровень ХГЧ в моче повышен.
Количество ХГЧ можно определить, только сдав анализ крови.
Когда можно сдать анализ крови на ХГЧ?
Уровень ХГЧ в крови начинает повышаться уже через 11 дней после зачатия (момента встречи яйцеклетки и сперматозоида). Анализ крови на уровень ХГЧ можно сдать через 11 дней после зачатия, или, если вы не знаете день предположительного зачатия, то через 3-4 недели после первого дня последней менструации.
Однократное измерение уровня ХГЧ иногда может быть не показательным. Поэтому при сомнительных результатах анализа женщине рекомендуется сдать повторный анализ через несколько дней. В норме на ранних сроках беременности уровень ХГЧ удваивается каждые 48-72 часа.
Какой уровень ХГЧ в норме у небеременных женщин?
В норме у небеременных женщин и у мужчин уровень ХГЧ от 0 до 5 мЕД/мл (mIU/ml).
Какой уровень ХГЧ в норме по неделям беременности?
Уровень ХГЧ в крови беременных женщин зависит от срока беременности. Уровень ХГЧ в норме повышается первые 8-11 недель беременности, а затем начинает постепенно снижаться.
Норма ХГЧ по неделям беременности (отсчет ведется от первого дня последней менструации!):
3 недели: 5 – 50 мЕД/мл (mIU/ml).
4 недели: 5 – 426 мЕД/мл (mIU/ml).
5 недель: 18 - 7,340 мЕД/мл (mIU/ml).
6 недель: 1,080 - 56,500 мЕД/мл (mIU/ml).
7-8 недель: 7, 650 - 229,000 мЕД/мл (mIU/ml).
9 -12 недель: 25,700 - 288,000 мЕД/мл (mIU/ml).
13 – 16 недель: 13,300 - 254,000 мЕД/мл (mIU/ml).
17 -24 недели: 4,060 - 165,400 мЕД/мл (mIU/ml).
25 – 40 недель: 3,640 - 117,000 мЕД/мл (mIU/ml).
Нужно знать: это не абсолютные показатели нормы, так как уровень ХГЧ может несколько отличаться от нормы у некоторых совершенно здоровых беременных женщин. Главное тут, скорее, это не уровень ХГЧ в крови, а его изменение в течение беременности (динамика).
Что, если во время беременности ХГЧ выше нормы?
Значительное повышение уровня ХГЧ в крови беременной может встречаться, если:
Срок беременности был определен неправильно (то есть, у вас больший срок, чем предполагалось)
У вас многоплодная беременность (двойня, тройня)
У вас пузырный занос (трофобластическая болезнь)
Если у вас повышен уровень ХГЧ в крови, то рекомендуется сдать повторный анализ через 48-72 часа для того чтобы исключить возможные ошибки и проследить за изменениями показателя.
Что, если во время беременности ХГЧ ниже нормы?
Низкий уровень ХГЧ во время беременности встречается, если:
Срок беременности был определен неправильно (то есть, у вас меньший срок, чем предполагалось)
У вас внематочная беременность.
У вас замершая беременность.
У вас возможен выкидыш.
Какие лекарства влияют на уровень ХГЧ в крови?
На уровень ХГЧ в крови могут повлиять лишь лекарства, которые сами содержат этот гормон (Прегнил, Хорагон). Эти лекарства применяются, главным образом, в лечении бесплодия (при поликистозе яичников, эндометриозе). Ни одно другое лекарство, а также алкоголь, курение, продукты питания, не могут исказить (повысить или понизить) результат анализа крови на ХГЧ.
Как меняется уровень ХГЧ после прерывания беременности (выкидыша или аборта)?
В большинстве случаев уровень ХГЧ приходит в норму через 4 – 5 недель после выкидыша или аборта.